Inscription / Connexion Nouveau Sujet
Pulvérisation nasale
Bonjour j'aurais besoin d'aide svp
Voila mon exercice :
Une pulvérisation nasale prescrite en cas de rhinite est une solution aqueuse de sulfure de sodium Na2S.
Sa notice donne les informations suivantes: " composition pour 10mL : 6,0 mg de sulfure de sodium.
Excipient non ionique à base d'édulcorants, d'eau purifiée et d'huile essentielle de Néroli".
Un laboratoire doit vérifier la notice.
Le technicien de ce laboratoire
décide de procéder à un dosage conductimétrique du sulfure de sodium.
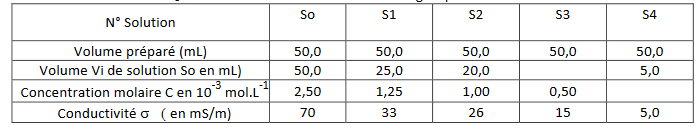
Il prépare une solution-mère So, par dissolution de sulfure de sodium de concentration Co = 2,5.10-3mol.L-1 puis par dilution de celle-ci, il obtient 4 solutions S selon les volumes indiqués ci-dessous et dont il mesure la conductivité
 S de ces solutions. Les résultats sont regroupés dans le tableau suivant :
S de ces solutions. Les résultats sont regroupés dans le tableau suivant :
Il mesure ensuite la conductivité de la pulvérisation diluée 10 fois et obtient conductivité  = 19 mS/m
= 19 mS/m
Voila mes questions :
1) Justifier que dans le cas présent, le contrôle de qualité puisse être fait par conductimétrie.
2)Compléter le tableau en indiquant le volume Vo de solution So qu'il a fallu prélever pour préparer la solution S3 et la concentration C4de la solution S4.
Merci d'avance
Salut,
Où est la difficulté, il suffit de connaître la définition d'une conductimétrie d'une solution, puis de l'exprimer en fonction d'un énoncé.
Ensuite, pour les dilutions : ![]() [lien]
[lien]

Merci,
1) Je ne sais pas c'est quoi la définition.. J'aurais dit parce que les différentes solutions sont conductances.
2) Pour les dilutions, du coup c'est pas rapport au facteur de dilution ?
1. C'est quoi la définition de la conductivité d'une solution ?
Quelle formule te permet de la lier aux concentration molaires des espèces ne présente ?
2. OUI ! Conclusion ? Tes calculs ?

1) Lier la concentration molaire avec quoi ?
2) Le facteur de dilution : F= Co/C1 = V1/V0
Le problème c'est que :
Par exemple pour la solution So :
On a Co=2.5x10^-3 mol.L-1
Lorsque je fais Co/C1, je trouve 1x10^-3, or ce n'est pas ce qu'il y a dans le tableau :/
Il faut que tu revois tes fondamentaux de chimie car ça risque de te faire très mal au bac ...
Question 1.
La conductivité d'une solution de la nature des ions présents dans cette solution et de leur concentration molaire
:
si est la conductivité molaire ionique de l'ion
.
L'équation de dissolution du sulfure de sodium dans l'eau est :
donc pour 1 mole de sulfure de sodium dissoute, il se forme 2 moles d'ions sodium et 1 mole d'ions sulfure
soit
Finalement, je peux donc exprimer la conductivité molaire de la solution ionique comme suit :
Conclusion ?
Question 2.
Pour S3, je soupçonne que V3 = 10,0 mL
Pour S4, je soupçonne que C4 = 0,25 mmol/L
Je te laisse t'approprier la fiche sur les dilutions pour que tu m'expliques pourquoi.

Merci de votre aide ,
Pour la 1, je ne suis pas certain du tout, je dirais par ce qu'on peut exprimer la conductivité en fonction de la concentration.
2) V3= C3*Volume préparé/ Co = (0.50*50.0x10-3)/2,5*10-3=10.0*-3L
C4= (Co*Vo)/Volume préparé

1. Si tu traces le graphique , que constates-tu ?
2. V3 OK
C4 = ?
Tu as oublié de faire l'application numérique.

1) J'obtiens une droite linéaire passant par l'origine, ce qui montre que ces 2 grandeurs sont proportionnelles
2) C4 = Co*Vp/Volume préparé = 2.5x10-3 * 5.0 / 50.0 x10-3 = 0.25 mmol/ L
1. Oui, ce qui est logique à la vue de ma démonstration :
Finalement, pour une solution donnée, si on mesure sa conductivité on peut en déduire sa concentration et donc sa qualité, non ?
OK pour C4.
Merci,
Oui donc ce contrôle de qualité peut se faire par conductimétrie car on pourra en déduire en déduire sa concentration et donc sa qualité.
C'est ça svp ?
D'accord, merci beaucoup !
J'ai encore quelques questions qui me posent problème, svp
Quelle masse m de sulfure de sodium Na2S solide, le technicien a t -il du peser pour préparer So par dissolution de ce soluté ?
Je pense qu'il faut utilise la formule : n=m/M
Puis ensuite il faut écrire l'équation de dissolution du sulfure de sodium dans l'eau.
J'ai écris : Na2S + H20 -> 2Na+ + HS- + H0-
Merci d'avance
Il faut que tu te concentres, j'ai déjà écrit l'équation de dissolution du sulfure de sodium dans l'eau ...
Cf. message du 09-04-17 à 15:06.
Ensuite, si tu connais la concentration de la solution So, par définition :
Co = n(Na2S)/Vo
n(Na2S) quantité de matière en soluté apporté
Vo volume de la solution
or n(Na2S) = m(Na2S)/M(Na2S)
donc on peut écrire Co = n(Na2S)/Vo = m(Na2S) / [M(Na2S) x Vo]
Finalement, la masse s'exprime de cette façon :
m(Na2S) = Co*M(Na2S)*Vo
Je te fais confiance pour l'application numérique, je ne l'ai pas faite  .
.
L'ordre de grandeur ne me paraît pas aberrant cependant.
Confiance en toi pour l'application numérique, le jour du contrôle je ne serai pas là  .
.
Tu as des moyens de vérifier ton calcul en recalculant la concentration Co par exemple avec cette valeur pour la masse.

D'accord, merci beaucoup est ce que vous pouvez m'aider pour les dernières questions svp ?
Pourquoi faut-il diluer le médicament avant la mesure conductimétrique ?
-> j'aurais dit : pour l'avoir en solution aqueuse
Quelle est la concentration "expérimentale"C en sulfure de sodium de cette pulvérisation ?
Le contrôle de la qualité conduit à une validation de la notice donc du médicament si l'écart relatif entre la valeur obtenue au contrôle et la valeur de référence affichée par le fabricant est inférieur à 10%.
La composition en sulfure de sodium de pulvérisation est -elle conforme à l'étiquetage ?
Merci d'avance
Pourquoi faut-il diluer le médicament avant la mesure conductimétrique ?
-> j'aurais dit : pour l'avoir en solution aqueuse
Réponse fausse, puisqu'une dilution se fait sur la base d'une solution déjà aqueuse, c'est le principe même du mode opératoire.
Tu n'as pas vu en cours pourquoi on doit diluer des solutions avant de faire de la conductimétrie ? Rien dans ton livre de chimie sur le sujet ?

Il me semble que pour des concentrations faibles, conductance et concentration sont proportionnelles.
A vérifier

D'accord merci !
Ensuite pour trouver la concentration "expérimentale" en sulfure de sodium, il faut utiliser
C= n/v
or n = m/M
c'est ça svp ?
Tu as suivi tout ce qu'on a fait depuis le début ensemble ou pas  ?
?
Tu as une solution mère initiale de concentration C0.
On la dilue pour pouvoir faire une mesure de conductimétrie avec une concentration plus faible C1.
Je t'ai déroulé la relation qui existe entre la concentration molaire et la conductivité de la solution (elles sont proportionnelles, cf. mon message du 09-04-17 à 15:06).
Finalement,
* en mesurant la conductivité de S1, tu peux en déduire C1 ;
* puis C0 par le biais du facteur de dilution.

Oui je suis, mais je suis mais je suis perdu..
Du coup la relation c'est :  = Co * (2
= Co * (2 Na +
Na +  S2-)/
S2-)/
La conductivité de S1 est :  = 33 mS/m
= 33 mS/m
D'après le tableau C1 : 1.25 * 10-3 mol.L-1
Et le facteur de dilution c'est 10
C'est ça ?:/ svp
Oui je suis, mais je suis mais je suis perdu
Attention, ta phrase dit tout et son contraire

Relis à tête reposée tout ce qu'on a fait ensemble : le facteur de dilution entre S0 et S1 est 2 et non 10 (regarde l'évolution de la concentration).

oups j'ai beugué effectivement ^^
J'ai biens compris pour le facteur de dilution
Donc S1 est 2 fois plus diluée que S0, on a donc C1/2 = C0
Donc je trouve C0 = 6.25 x 10-4 mol.L-1
Tu l'as déjà cette information dans ton tableau qu'on a complété :

Je commence à être paumé sur ce que tu cherches à faire 
vous m'avez dit "en mesurant la conductivité de S1, tu peux en déduire C1 ;puis C0 par le biais du facteur de dilution"
du coup je pensais qu'il fallait faire comme ça
Du coup C0 = 2,50 x10-3 mol.L-1
Je vois pas du tout ensuite...
j'ai l'impression qu'à partir de ton message du 12-04-17 à 10:10, tu as posté une nouvelle bribe d'énoncé, mais que ce dernier n'est pas complet ...
Ce qui me donne l'impression qu'on tourne en rond à présent.
Si je reprends, après qu'on ait rempli le tableau, tu cherches à déterminer la concentration de cette solution :
Il mesure ensuite la conductivité de la pulvérisation diluée 10 fois et obtient conductivité
 = 19 mS/m
= 19 mS/mAvec le tableau, on constate que cette conductivité est comprise entre S2 et S3 :

Donc C2 < C < C3.
Si tu connais les conductivités ioniques molaires, tu peux alors déterminer cette concentration de manière plus fine :
La conductivité d'une solution de la nature des ions
si
L'équation de dissolution du sulfure de sodium dans l'eau est :
donc pour 1 mole de sulfure de sodium dissoute, il se forme 2 moles d'ions sodium et 1 mole d'ions sulfure
soit
Finalement, je peux donc exprimer la conductivité molaire de la solution ionique comme suit :
avec
Finalement,
Oui c'est bien ça,
en faite après le tableau on nous demande la masse de sulfure de sodium Na2s solide..
-> m = 10 g
puis l'équation de dissolution du sulfure de sodium dans l'eau
Na2S -> 2 Na + + S2-
pourquoi il faut diluer le médicament avant la mesure conductimétrique
pour que ce soit proportionnels
puis ensuite la concentration "expérimentale" en sulfure de sodium de cette pulvérisation
C=  /k = 19 /2
/k = 19 /2
c'est ça le calcul s'il vous plait ?
m(Na2S) = Co*M(Na2S)*Vo
Co = 2,5.10^(-3) mol/L
Vo = 50,0 mL = ... L
M(Na2S) = 2M(Na) + M(S) = ...
OK pour l'équation-bilan
pourquoi il faut diluer le médicament avant la mesure conductimétrique
pour que ce soit proportionnels
Tu as vérifié mes dire du coup, je n'étais pas sûr.
Concernant le dernier calcul, quelle est l'unité de k ?

Pour avancer, j'ai tracé sur Excel (tu peux aussi le faire avec ta calculatrice graphique) la courbe sigma = f(C) :
* sigma en mS/m
* C en mol/L
Tu peux, par l'intermédiaire d'une courbe de tendance, trouver l'équation de la droite :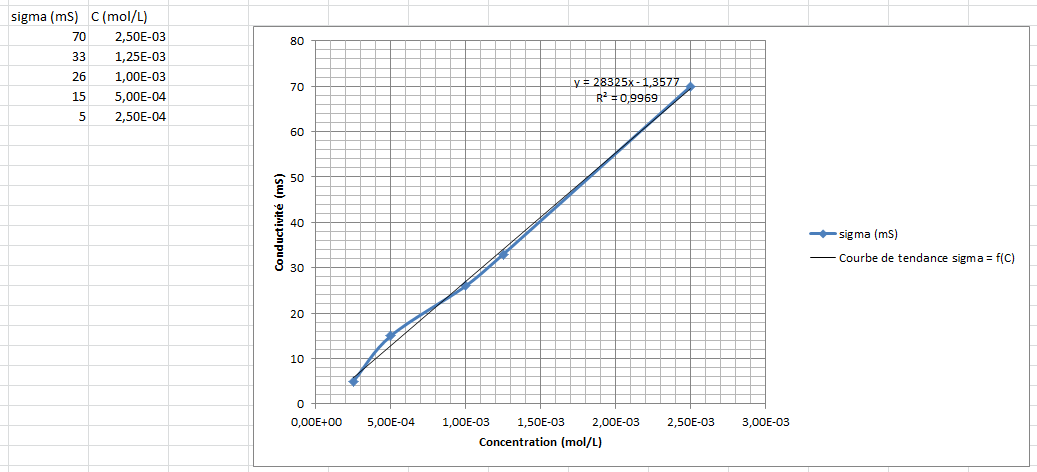
Ainsi, tu peux en déduire la concentration de ta solution.
D'accord merci beaucoup, donc d'après le graphique, la concentration expérimentale vaut 5.00x10-4 mol/L c'est ça ?
Du coup je n'ai pas besoin du calcul : C=  /k ?
/k ?
Tu remarques que la courbe de tendance passe très près de l'origine, on pourrait donc écrire sans trop d'approximation que :
y = 28325*x, ce qui est bien de la forme sigma = k*C
Puisqu'on a l'équation de la droite, autant s'en servir :
y = 28325*x - 1,3577
si y = 19 mS, alors on cherche x tel que :
19 = 28325*x - 1,3577
<=> 19 + 1,3577 = 28325*x
<=> x = (19 + 1,3577)/28325
<=> x = 20,3577/28325 = 0,719.10-3 mol/L
ce qui est bien compris entre C2 et C3 comme on l'a vu précédemment avec le tableau de mesures, contrairement à ton résultat proposé.
Maintenant qu'on a fini cet exercice, voici quelques conseils pour le bac : tu as de grosses lacunes sur les fondamentaux de chimie, il faut absolument que tu les maîtrises avant l'examen de juin.
En particulier :
* connaître par coeur cette fiche :
- ![]() [lien]
[lien]
--> par exemple dans ton exercice, tu ne savais même pas me définir la conductivité de la solution de sulfure de sodium, ce qui était fondamental pour le résoudre.
* il faut que tu connaisses par coeur les protocoles de dilution :
- ![]() [lien]
[lien]
* Il faut que tu saches également écrire une équation de dissolution ou une équation-bilan sans te tromper et par dessus tout équilibrée --> dans ton exercice, tu as remarqué qu'il fallait connaître par coeur les formules des principaux ions rappelées ici :
- ![]() Tests de reconnaissance des principaux ions
Tests de reconnaissance des principaux ions

Oui merci beaucoup pour toute votre aide,
Il y a un dernier petit problème : comme dans mon exo, je n'ai pas l'équation de la droite, je dois trouver le coefficient directeur ?
Puis ensuite il y a encore la dernière question que l'on a pas faite svp
Bah si tu l'as équation de la droite : avec ta calculatrice, tu traces la courbe et tu peux déterminer son coefficient directeur, c'est exactement pareil que sur Excel, lis le manuel utilisateur  .
.
Quelle question ?
Ah ok :
Le contrôle de la qualité conduit à une validation de la notice donc du médicament si l'écart relatif entre la valeur obtenue au contrôle et la valeur de référence affichée par le fabricant est inférieur à 10%.
La composition en sulfure de sodium de pulvérisation est -elle conforme à l'étiquetage ?
Par le biais du calcul précédent, on connaît la valeur expérimentale de la concentration de la pulvérisation --> Cexp (exp = expérimentale) ;
Une pulvérisation nasale prescrite en cas de rhinite est une solution aqueuse de sulfure de sodium Na2S.
Sa notice donne les informations suivantes: " composition pour 10mL : 6,0 mg de sulfure de sodium.
Excipient non ionique à base d'édulcorants, d'eau purifiée et d'huile essentielle de Néroli".
On peut donc déterminer la valeur théorique de la concentration molaire :
Cth = n(Na2S)/V = m(Na2S)/[M(Na2S)*V]
car n(Na2S) = m(Na2S)/M(Na2S)
avec
m(Na2S) = 6,0 mg = ... g
V = 10 mL = ... L
M(Na2S) = 2M(Na) + M(S) = ... g/mol
donc Cth = ... mol/L
Quelle est alors la définition de l'écart relatif (à connaître également par coeur) ?

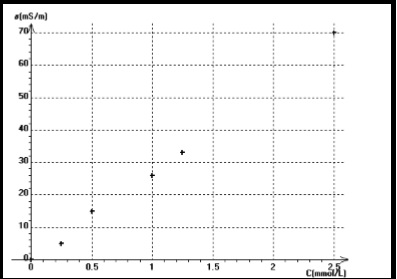
voila ce que j'ai comme graphique
Du coup, on peut trouver le coefficient directeur en prenant 2 points A (0,5 ; 15x10-3) B( 1 ; 26x10-3).
YB-YA/XB-XA = 0,042
De plus on a  = 19 mS/m donc
= 19 mS/m donc  =y=19mS/m
=y=19mS/m
Mais après je sais pas comment faire, je n'arrivais pas à raisonner comme vous..
Du coup, je ne peux pas faire la question d'après qui est la dernière question, car je n'ai pas la concentration expérimentale
Tu as regardé ton manuel utilisateur pour savoir comment faire une interpolation de ta courbe par une droite ?
Si oui, l'interpolation graphique te donnera directement le coefficient directeur de cette droite affine (qui ne passe pas tout à fait par l'origine comme on l'a vu plus haut).
Après, oui, tu peux très bien le déterminer de la façon que tu m'exposes, sauf qu'il y aura potentiellement plus d'approximation qu'avec une interpolation de calculatrice.
Ta méthode est très bien si par exemple l'usage de la calculatrice est interdit le jour du bac :
la courbe est de la forme y = a*x + b
a = coefficient directeur = (Y1 - Y0)/(X1-X0) par exemple
b = ordonnée à l'origine (x = 0)
Ensuite c'est comme pour Excel : on cherche x tel que y = 19 mS
donc 19 = a*x + b (a et b déterminés)
<=> x = (19-b)/a
Je pense que je suis obligé de faire comme ça non ?
Le graphique que j'ai posé c'est le graphique du prof
si je continue j'obtiens a = 0.042 mais b je ne sais pas :/
Sauf si l'exercice te dit que la calculatrice est interdite, je te conseille d'apprendre à utiliser l'interpolation de la courbe, ce sera l'occasion de voir si tu maîtrises cette fonctionnalité très importante ou non  .
.
Car je suis d'accord avec toi, tu peux déterminer - en première approche - le coefficient directeur, en revanche, ce sera difficile de déterminer b ...

a = (Y0 - Y1)/(X0 - X1) = (70-33)/(2,50.10-3 - 1,25.10-3) = 29600 SI.
Or avec mon interpoltation sur Excel, on avait trouvé a = 28325 SI.
Tu constates donc qu'il y a tout de même un écart entre les deux valeurs.
Bon, une fois que tu auras fait l'interpolation avec ta calculatrice, tu auras la concentration expérimentale Cexp --> que vaut l'écart relatif entre la valeur théorique Cth calculée et celle expérimentale ?

D'accord, je vais voir ça 
Est ce que votre interpolation de votre courbe doit être la même que la mienne ?
En principe oui, fais juste attention aux unités choisies pour ta courbe : par exemple j'avais mis la conductivité en mS/m et la concentration molaire en mol/L.
Pour ta part tu as laissé ta concentration en mmol/L, donc à la puissance près, ton résultat sera différent dans un premier temps, il faudra dans ce cas être vigilant sur l'unité de Cexp pour revenir à mon résultat.

Oui c'est ça, sauf que la formule de Taylor-Young est hors programme pour toi, voilà pourquoi tu auras :
* soit un tracé d'une droite passant pas l'origine, auquel cas tu sais calculer son coefficient directeur ;
* soit c'est un peu plus compliqué, et dans ce cas tu le fais avec la calculatrice.
Je ne comprends pas pourquoi tu tiens à tout prix à utiliser ces formules 
Tu as regardé tu manuel utilisateur de ta calculatrice ?
Sinon, tu peux utiliser mon interpolation avec Excel ou le calcul approximé : cf. messages du 15-04-17 à 15:16 et 16-04-17 à 09:51.
L'écart relatif vaut par définition :
Donc ici


 10 g
10 g


