Inscription / Connexion Nouveau Sujet
ph
Bonjour,
je ne n'arrive pas à poser mes calculs: 'On dose 10 ml de HCl par NaOH 0,1 M.
Quel est le pH après 0 ml de NaOH et 2,5 ml de NaOH.
c1 v1= c2
v1= c2 v2
v2
c1 et v1 c'est pour HCL et c2 et v2 c'est pour NaOH.
Pour 0 ml :
10 ml x C1 = O ml x 0,1 M
mais ça ne joue pas :/
merci
Schéma annoté du dosage :
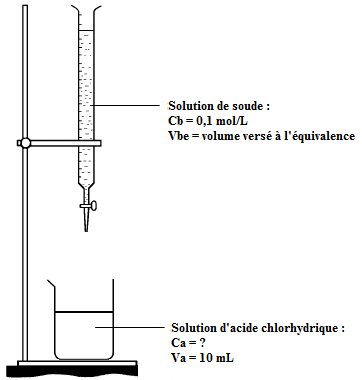
Solution de soude :
Solution d'acide chlorhydrique :
Quelle est l'équation de la réaction ?

FAUX.
La façon dont tu l'écris suppose que ce sont des solides qui réagissent.
Regarde comment j'ai écris les solutions que j'ai écrites en-dessous du schéma.
Ecris les couple acido-basiques intervenant (avec les demi-équations) puis l'équation de la réaction du dosage
H_3O^+ \rightarrow H^+ + H_2O \\ OH^- + H^+ \rihgtarrow H_2O
_________________________________
H_3O^+ + OH^- \rightarrow \red{2} H_2O
(faute de frappe)

Tu as déjà écrit l'équation de la réaction, et je te rappelle que deux solides ne réagissent pas entre eux

On passe maintenant à la suite de l'exercice maintenant qu'on a posé les bases.
Qu'est-ce qu'on te demande exactement ?
La concentration d'un solide ?
Je suis désolé de t'embêter avec ça mais si tu confonds les deux tu vas être ennuyé par ton prof :
NaCl sont les cristaux que tu dissous pour obtenir la solution d'hydroxyde de sodium :
Quelle est la question posée par l'énoncé de l'exercice ?
calculer le ph après 0 ml de naoh et après 2,5 ml de naoh
il faut donc calculer la concentration de l'acide pour ensuite faire la formule de logarithme selon moi.
Ceci n'est valable qu'à l'équivalence dans ce cas (attention, ta façon de l'écrire n'est pas vraie dans tous les cas à l'équivalence).
Tu peux faire un tableau d'avancement de la réaction par exemple non  ?
?
Tu le fais de manière générale, ensuite tu peux exprimer les quantités de matières en fonction du volume introduit non ?
j ai malheureusement omis une information capitale le ph 7 est à 10 ml de Naoh. Je suis sincerement désolée.
Voila,
donc tu peux déterminer la concentration en ion H3O+ non ?
Et tu peux déterminer la valeur de la concentration en ions OH- à partir du produit ionique de l'eau non ?

la concentration est donc de 10^-7 pour H3O + et donc pour la concentration de OH- cela équivaut à 10^-7 également.
Bah non,
Si tu ajoute plus ou moins de dans la solution d'acide, la concentration en ion
va diminuer du faite de la réaction du dosage.
Mais tu peux exploiter le produit ionique de l'eau non ?

Schéma de la situation :
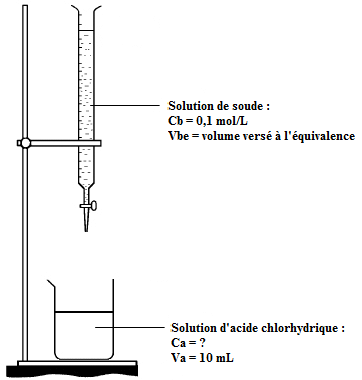
Equation de la réaction :
En utilisant mes notations :
= volume versé dans la solution d'acide
Tableau d'avancement de la réaction :
à Vb = 0 mL
[tex][H_3O^+] = C_a = concentration initiale de la solution.
L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechiométriques donc :
En effet l'énonce t'indiquait une chose :
le fait que le pH de la solution est pH = 7 pour 10 mL de soude versée te dit que la solution est NEUTRE, donc que tu es à l'équivalence.
soit
tu connais donc la concentration initiale de la solution d'acide.
donc sans ajout de soude (Vb = 0 mL)
on a pH = -log(0,1) = ...


