Inscription / Connexion Nouveau Sujet
oxydoréduction incompris
 etudiantilois
etudiantiloisBonjour,
Voici mon sujet :
On veut suivre par spectrophotométrie l'évolution de la réaction entre une solution aqueuse d'eau oxygénée et une solution d'iodure de potassium. Le mélange se colore lentement par suite de l'apparition de diiode coloré. Toutes les autres espèces chimiques intervenant sont incolores. La réaction entre l'eau oxygénée et l'iodure de potassium a lieu en milieu acide. Elle est lente mais totale si on attend suffisamment longtemps.
1. Écrire l'équation chimique de la réaction étudiée.
2. Cette réaction peut-elle être suivie par spectrophotométrie ?
Mes questions :
- que signifie réaction totale ?
- comment trouver les formules de l'iodure de potassium, et de l'eau oxygénée ? Doit-on les connaitre par coeur ?
- pourquoi préciser en milieu acide ? Est-on dans un cas d'oxydoréduction ; si oui, pourquoi ?
- comment établir l'équation de la réaction ?
- comment montrer qu'on peut suivre la réaction par spectrophotométrie ?
Je vous remercie d'avance beaucoup pour votre aide.
Bonne journée.
Salut,
Je suis assez inquiet que tu poses ces questions en terminale, sachant que ce sont des notions abordées en première et seconde  .
.
Alors,
- que signifie réaction totale ?
Une réaction est dite totale lorsque l'un des deux réactifs de la réaction considérée a entièrement réagi : sa quantité de matière est donc nulle a l'état finale.
Dans le cas où les deux réactifs ont entièrement réagi, c'est qu'ils ont été introduits dans des proportions stoechiométriques.
Rappels de cours :
* tableau d'avancement de la réaction (avec la notion d'avancement maximal introduite) : ![]()
* exemple de réaction où les réactifs sont introduits dans les proportions stoechiométriques --> les réaction de dosage à l'équivalence : ![]() [lien]
[lien]
- comment trouver les formules de l'iodure de potassium, et de l'eau oxygénée ? Doit-on les connaitre par coeur ?
OUI ! Il faux que tu connaisse par coeur les formules des principaux ions, il n'y a pas d'autre alternative envisageable, sinon tu vas avoir de sérieux problèmes aux examens ...
Rappel de cours :
* ![]()
* il y a également une fiche dans la section pratique que je te recommande vivement, mais il y a un problème de lien pour l'instant (en cours de traitement) : ![]() [lien]
[lien]
- pourquoi préciser en milieu acide ? Est-on dans un cas d'oxydoréduction ; si oui, pourquoi ?
Il faut que tu écrives l'équation de cette réaction pour répondre à la question
- comment établir l'équation de la réaction ?
C'est du cours  . Il faut se donner la peine d'apprendre régulièrement tes leçons au risque de souffrir au bac (désolé de te secouer un peu, mais tu n'as pas le choix).
. Il faut se donner la peine d'apprendre régulièrement tes leçons au risque de souffrir au bac (désolé de te secouer un peu, mais tu n'as pas le choix).
Rappel de cours :
* ![]() [lien]
[lien]
* il faut que tu t'entraîne à équilibrer des équations ox/réd.
- comment montrer qu'on peut suivre la réaction par spectrophotométrie ?
Peux-tu déjà me rappeler le but de la spectrophotométrie ?
Bonjour,
Toutes les leçons que vous m'avez données sont connues et apprises. Je vous remercie de me les avoir données. Néanmoins, lorsque l'on connait les ions, comment trouver la formule de la solution ?
OK pour réaction totale.
Néanmoins, je ne comprends toujours pas pourquoi on a précisé que la réaction a lieu en milieu acide. Je ne trouve pas non plus votre fiche pratique... N'y aurait-il pas des erreurs dans les formules des ions ?
J'essayerai d'exprimer l'équation quand j'aurais les formules... Mais comment trouver ici les couples ?
MERCI beaucoup.
Et comment trouver la formule d'un soluté, comme acide chlorydrique, acide sulfurique, ou hydroxyde de sodium, à partir des ions que l'on a appris ?
Puis ici comment trouver, pour établir l'équation, tous les réactifs et les produits ?
Merci d'avance.
Toutes les leçons que vous m'avez données sont connues et apprises. Je vous remercie de me les avoir données. Néanmoins, lorsque l'on connait les ions, comment trouver la formule de la solution ?
En connaissant les principaux ions tu es en mesure de déterminer les formules des solutions.
Exemple : iodure de potassium
Iodure : anion I-
ion potassium : cation K+
Donc la solution sera (K+ + I-)
Dans ce cas-là c'est simple, dans d'autres cas il faut équilibrer en charges.
OK pour réaction totale.
OK
Néanmoins, je ne comprends toujours pas pourquoi on a précisé que la réaction a lieu en milieu acide. Je ne trouve pas non plus votre fiche pratique... N'y aurait-il pas des erreurs dans les formules des ions ?
Tu as très certainement vu que l'eau oxygéné = péroxyde d'hydrogène = H2O2
J'essayerai d'exprimer l'équation quand j'aurais les formules... Mais comment trouver ici les couples ?
Dans l'énoncé on te parle de formation de diiode : le premier couple en jeu est donc
Ensuite, on a de l'eau oxygénée en solution AQUEUSE donc le deuxième couple en jeu est
Je te laisse donc écrire l'équation d'oxydoréduction en jeu  .
.
Merci pour votre réponse.
Avec les deux couples, on a :
H2O2 + 2 H+ + 2 e- => H2O + H2O
Donc : H2O2 + 2 H+ + 2 e- => 2H2O
On a aussi, pour le deuxième couple :
I2 + 2 e- => 2 I-
Donc, au total :
H2O2 + 2 H+ + I2 => 2 I- + 2 H2O
Est-ce juste, et pour les demi-équations, comment savoir si elles sont "dans le bon sens", c'est-à-dire que l'on part d'un réducteur pour donner un oxydant et inversement ?
Et de plus, pourquoi n'y a-t-il pas la formule de l'iodure de potassium dans l'équation ? Il n'intervient dans aucun couple ? Et sa formule n'est-elle pas KI, plutôt que (K+ + I- ) ?
Merci d'avance pour votre réponse.
Donc : H2O2 + 2 H+ + 2 e- = 2H2O
On a aussi, pour le deuxième couple :
I2 + 2 e- = 2 I-
TB !
Ensuite tu te prends la tête pour rien : quels sont les réactifs en jeu ?
On a bien parlé de peroxyde d'hydrogène : ta première demi-équation est donc dans le bon sens H2O2 + 2 H+ + 2 e- = 2H2O
Ensuite, on parlait d'ion iodure : donc là il faut que la demi-équation se fasse dans ce sens : 2 I-
En effet, par définition, une réaction d'oxydoréduction est la réaction entre un oxydant et un réducteur de deux couples ox/réd différents.
Or là tu voulais faire réagir deux oxydants, tu te rends comptes très vite que ça ne marchera pas

En corrigeant ton équation-bilan, tu vas en déduire pourquoi on doit faire cette réaction en milieu acide.
_____________________________________________
Concernant ta deuxième question, tu peux très bien écrire l'équation avec le potassium, mais étant donné que c'est un ion spectateur, il sera donc àla fois présent côté réactifs et côté produits --> tu peux donc simplifier l'équation-bilan comme suggéré plus haut
 .
.Enfin, on parle de solution AQUEUSE, or KI est de l'iodure de potassium SOLIDE, il faut donc faire entrer en jeu une dissolution de ce composé dans l'eau :
KI --> K+ + I-. Voilà pourquoi j'ai écrit au tout début (K+ + I-)

OK pour vos explications avant le trait, merci !
Mais comment savoir dans les exercices que l'on a un ion spectateur ?
Et comment savoir que c'est un solide, KI ? Comment savoir dans quel cas on a (K+ + I-)
ou KI ? Comment savoir dans un exercice qu'on a une dissolution ?
Aurait-on pu trouver la formule H2O2 seul ? Auriez-vous des exemples dans lesquels on doit équilibrer les charges ? Merci.
Voici l'équation qu'on aurait après ce que vous m'avez dit :
H2O2 + 2 H+ + 2 I- => I2 + 2 H2O
Et si on met les ions spectateurs c'est correct : ?
H2O2 + 2 H+ + 2 I- + K => I2 + 2 H2O + K
Mais comment savoir dans les exercices que l'on a un ion spectateur ?
L'énoncé te donne souvent des indications sur les réactifs en jeu (ici on te dit implicitement ce sont bien H2O2 et I-.
Et comment savoir que c'est un solide, KI ? Comment savoir dans quel cas on a (K+ + I-)
ou KI ? Comment savoir dans un exercice qu'on a une dissolution ?
NaCl est un solide, (Na+ + Cl-) une solution aqueuse
CaF2 est un solide, (Ca2+ + 2F-) une solution aqueuse.
A partir du moment que tu es en milieu aqueux, tu dois faire intervenir les solutions aqueuses.
Aurait-on pu trouver la formule H2O2 seul ? Auriez-vous des exemples dans lesquels on doit équilibrer les charges ? Merci.
Je t'ai donné un lien sur les dosages, il y a dedans deux exemples d'oxydoréductions : ![]() [lien]
[lien]
Voici l'équation qu'on aurait après ce que vous m'avez dit :
H2O2 + 2 H+ + 2 I- => I2 + 2 H2O
TB
Et si on met les ions spectateurs c'est correct :
H2O2 + 2 H+ + 2 I- + K => I2 + 2 H2O + K
Comme expliqué plus haut, la solution aqueuse de iodure de potassium est (K+ + I-) donc c'est plutôt :
H2O2 + 2 H+ + 2(I- + K+) => I2 + 2 H2O + 2K+
Remarque importante : pour que la réaction se fasse, tu remarques qu'il faut la présence d'ions H+. Voilà pourquoi il faut un milieu ACIDE.
Merci pour votre réponse.
Où nous dit-on implicitement que ce sont bien H2O2 et I- ?
Dans l'équation de la réaction, faut-il mettre le jour du contrôle les ions spectateurs ?
Y en a-t-il une fausse, une correcte, ou les deux sont-elles correctes ?
Quand on met juste solution cela veut dire solution aqueuse ?
***
Si picard ne me répond d'ici 18 heures, pourriez-vous regarder mon sujet de physique. Il m'a déjà donné une réponse très intéressante, mais j'ai encore des questions importantes. Merci d'avance.
OK. Merci beaucoup.
En chimie, comment déterminer un temps de demi-réaction sans un graphique ?
*** message déplacé ***
C'est une nouvelle question sans rapport avec ce qui précède, ouvrez un nouveau topic...
A priori, on ne vous demandera jamais de faire ça !
*** message déplacé ***
OK. Effectivement j'aurais dû ouvrir un nouveau topic (même pour une si petite question, cela n'encombre pas le forum ?) ! Désolé.
Donc pour le déterminer on utilisera toujours le graphique ?
*** message déplacé ***
Quand on a un graphique avec A=f(t), comment déterminer ce temps de demi-réaction ? J'ai aussi la concentration maximale.
*** message déplacé ***
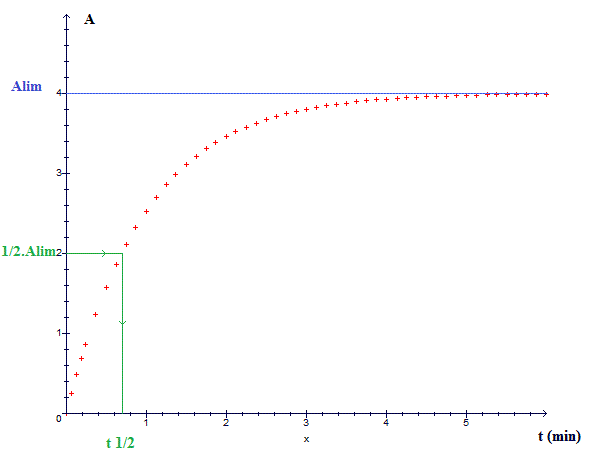
A la demi réaction, l'avancement est égal à la moitié de l'avancement maximal.
Si vous connaissez la concentration maximale, déduisez l'absorbance maximale correspondante Amax ; à t1/2, on aura A = 1/2 Amax.
Il est difficile de répondre à ce genre de question sans connaitre précisément le contexte.
*** message déplacé ***
Où nous dit-on implicitement que ce sont bien H2O2 et I- ?
Il faut que tu te concentres lorsque tu lis un énoncé :
On veut suivre par spectrophotométrie l'évolution de la réaction entre une solution aqueuse d'eau oxygénée (donc H2O2) et une solution d'iodure de potassium (donc (K+ + I-) ). Le mélange se colore lentement par suite de l'apparition de diiode (soit I2, tu en déduis donc que le couple en jeu est I2/I-) coloré. Toutes les autres espèces chimiques intervenant sont incolores. La réaction entre l'eau oxygénée et l'iodure de potassium a lieu en milieu acide. Elle est lente mais totale si on attend suffisamment longtemps.
Dans l'équation de la réaction, faut-il mettre le jour du contrôle les ions spectateurs ?
Y en a-t-il une fausse, une correcte, ou les deux sont-elles correctes ?
Tout dépend de ton professeur : certains veulent que les ions spectateurs, d'autres pas. Personnellement je ne les mets pas.
Les deux restent cependant correctes, c'est juste que tu risques de d'embrouiller davantage en les faisant intervenir (on l'a bien vu plus haut)
Quand on met juste solution cela veut dire solution aqueuse ?
OUI, sauf précisions supplémentaires
up et question supplémentaire : comment déterminer un temps de demi-réaction sans un graphique ?
Cf la fiche de rappel du cours : ![]() [lien]
[lien]

Si j'écris x = avancement
tu peux déterminer x en fonction du temps.
Le temps de demi-vie T est lorsque x(T) = 1/2.xlimite w<=> T = ?
Difficile d'en dire plus sans un énoncé complet

Attends, je ne comprends plus rien, tu as un graphique ou pas ?
Tu écris une chose et son contraire ensuite
Première question de l'exo : Déterminer la relation numérique entre A350 et c grâce à la courbe d'étalonnage.
J'ai trouvé : A350=2,5*10^5*c.
Voici la fin de l'exercice :
Dans la cuve du spectrophotomètre, on introduit un volume V1=3,0 mL d'une solution d'iodure de potassium acidifiée, de concentration C1=1,0*10^-2 mol/L, puis un volume V2=0,50 mL d'une solution d'eau oxygénée de concentration C2=5,0*10^-5 mol/L.
Calculer la concentration en diiode [I2]max dans la cuve du spectrophotomètre à un instant où on pourra considérer la transformation comme terminée.
J'ai trouvé : [I2]max=(nI2)f/(V1+V2) (est-ce correct ?) =2,5*10^-8/3,5*10^-3=7,142^10^-6 mol/L.
Quelle absorbance Amax peut-on prévoir à cet instant ?
D'après 1) : A350=2,5*10^5* c.
Donc Amax= 2,5*10^5*[I2]max=2,5*10^5*7,142*10^-6=1,785.
La courbe A350 est donnée.
Peut-on considérer que l'état final a été atteint ?
J'ai mis que : on remarque que Amax=1,79 au bout de 25 min. Or d'après 7), Amax=1,785.
Donc l'état final a été atteint.
Déterminer la valeur du temps de demi-réaction.
Je ne sais pas...
MERCI.
Et comment montrer que cette réaction peut être suivie par spectrophotométrie ?
Svp gbm ne partez pas... J'ai besoin de votre aide...
Un conseil pour la prochaine fois : évite de poster un exercice par bribes, car ça rend l'aide très difficile pour le correcteur ...
Première question de l'exo : Déterminer la relation numérique entre A350 et c grâce à la courbe d'étalonnage.
J'ai trouvé : A350=2,5*10^5*c.
Etant donné que je n'ai pas tout l'exercice, difficile de te donner des réponses précises. Mais si tu appliques la loi de Beer-Lambert tu obtiens bien une expression de ce style oui.
Dans la cuve du spectrophotomètre, on introduit un volume V1=3,0 mL d'une solution d'iodure de potassium acidifiée, de concentration C1=1,0*10^-2 mol/L, puis un volume V2=0,50 mL d'une solution d'eau oxygénée de concentration C2=5,0*10^-5 mol/L.
Calculer la concentration en diiode [I2]max dans la cuve du spectrophotomètre à un instant où on pourra considérer la transformation comme terminée.
J'ai trouvé : [I2]max=(nI2)f/(V1+V2) (est-ce correct ?) =2,5*10^-8/3,5*10^-3=7,142^10^-6 mol/L.
Je ne comprends pas d'où vient "2,5*10^-8" sans explications mais ton expression littérale est correcte. Il faut faire un tableau d'avancement de la réaction et déterminer l'avancement maximal. Puis en déduire la quantité de matière I2 finale.
Ensuite tu peux appliquer ta formule de ci-dessus.
Quelle absorbance Amax peut-on prévoir à cet instant ?
D'après 1) : A350=2,5*10^5* c.
Donc Amax= 2,5*10^5*[I2]max=2,5*10^5*7,142*10^-6=1,785.
La courbe A350 est donnée.
Peut-on considérer que l'état final a été atteint ?
J'ai mis que : on remarque que Amax=1,79 au bout de 25 min. Or d'après 7), Amax=1,785.
Donc l'état final a été atteint.
Ton raisonnement est correcte, pour les applications numériques, je te fais confiance étant donné que je n'ai pas tous les éléments à disposition.
Déterminer la valeur du temps de demi-réaction.
Oui elle a cette allure !
Et pour justifier j'écris quoi ?
car Amax=A/2Amax, on ne l'a pas dans le cours ?
Si, et j'ai besoin d'aide pour mon exercice de skieur sur le site et personne ne peut m'auder. Puis-je le poster sur l'île ?
Oui elle a cette allure !
Et pour justifier j'écris quoi ?
car Amax=A/2Amax, on ne l'a pas dans le cours ?
Applique la définition du temps de demi-vie d'une réaction rappelée par picard et moi-même tout simplement

Regarde bien tous les liens de mon message du 25-09-16 à 21:12

Je peux poster l'exo du skieur dans un nouveau topic ? Pourriez-vous y répondre ? C'est juste une correction, j'ai terminé l'exo.
Si, et j'ai besoin d'aide pour mon exercice de skieur sur le site et personne ne peut m'auder. Puis-je le poster sur l'île ?
Oui tu peux le poster, mais attention :
Je dois vraiment y aller, bon courage ! Je t'ai passé plein de liens et ton exercice du skieur est très classique, je pense que tu le trouveras (ou un équivalent) dans le moteur de recherche.
Bonne soirée,



 moteur de recherche
moteur de recherche page de choix du forum
page de choix du forum fiches du site
fiches du site
