Inscription / Connexion Nouveau Sujet
ondes mécaniques progressives
Bonsoir à tous !
J'ai un exercice de physique à faire sur lequel je bloque complétement, l'énoncé est le suivant : Un modéle de calcul de la célérité du son dans un gaz diatomique ou dans l'air donne la relation suivante :
v=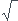 ((1.4P)/
((1.4P)/ ) avec P la pression du gaz au repos et
) avec P la pression du gaz au repos et  la masse volumique du gaz.Les valeurs sont en bon accord avec les valeurs déterminées expérimentalement.
la masse volumique du gaz.Les valeurs sont en bon accord avec les valeurs déterminées expérimentalement.
On admet que ces gaz vérifient la loi des gaz parfaits, c'est-à-dire:
P.V = (m.R.T)/M
où V est le volume occupé par une masse m de gaz de masse molaire M sous la pression P, à la température absolue T.
1) Montrez que la célérité ne dépend pas de la pression du gaz mais dépend de la température et de la masse molaire.
2)La célérité du son dans le dihydrogène est-elle plus grande que dans le dioxygène ? Justifier.
3)A 0°C = 273 K, la célérité du son dans l'air est de 331.45 m.s.En admettant que la formule est valable pour l'air, calculer la masse molaire de l'air.
4)Calculer les célérités du son dans le dihydrogène et le dioxygène.
Données : à 20°C , R=8.314 S.I., M(H2)=2.0g.mol;M(O2)=32 g.mol
Donc là je suis entrain d'essayer de faire la 2,3 et 4 mais la 1 je ne sais pas trop comment m'y prendre quelqu'un pourrait'il m'aider svp ?
Merci !
Bonsoir,
1,4 P /  = ... ?
= ... ?
On te dit que ces gaz vérifient la loi des gaz parfaits
P.V = m.R.T / M
 est la masse volumique, c'est-à-dire la masse par unité de volume...
est la masse volumique, c'est-à-dire la masse par unité de volume...

Salut:
1)
=>
d'ou: ==>
donc :
donc la célérité ne dépend pas de la pression du gaz mais dépend de la température et de la masse molaire.
2)dans le dihydrogène :
dans le dioxygène :
M(H2)=2.0g.mol;M(O2)=32 g. =>M(H2)<M(O2) ==>v(H2)>v(O2)
oui La célérité du son dans le dihydrogène est plus grande que dans le dioxygène.
3) ==>
==>
A.N. :
4) célérité du son dans le dihydrogène:
et dans le dioxygène:


