Inscription / Connexion Nouveau Sujet
extraction de la vanilline
Bonjour j'aimerais avoir de l'aide pour cet exercice type bac :
Le spectre d'absorption de la vanilline, pour une longueur d'onde  comprise entre 200 et 800nm ne présente qu'une unique absorption de 348nm.
comprise entre 200 et 800nm ne présente qu'une unique absorption de 348nm.
a) La vanilline est elle colorée et si oui de quelle couleur est elle ?
b) Quelle loi, reliant l'absorbance à la concentration, permet de tracer une courbe d'étalonnage reliant linéairement l'absorbance d'une solution à sa concentration en vanilline ?
Droite d'étalonnage : Dans une fiole jaugée de V0=1,000L, préparer une solution mère F0 contenant m=100mg(soit 0,6579mmol) de vanilline et 4g d'hydroxyde de sodium. Préparez par ailleurs un litre d'une solution S0 d'hydroxyde de sodium (CH0-=0,1mol.L, soit 4 g d'hydroxyde de sodium par litre d'eau). Dans une fiole jaugée de volume V1=100ml, introduire à la pipette jaugée V2=1ml de F0 et ajouter S0 jusqu'au trait de jauge, F1 est cette solution fille. Préparez de même mes solutions F2 à F6 en diluant, dans des fioles de 100ml, les volumes V=2;3;4;5;6ml de F0 avec S0. Mesurez l'absorbance A de ces différentes solution à 348nm et tracer la droite A=f(c).
c) Pourquoi choisir de mesurer l'absorbance de la solution pour une longueur d'onde de 348nm ?
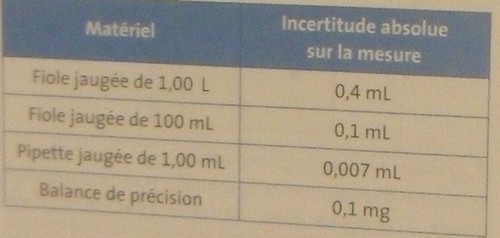
d) Donner l'expression de la concentration molaire c1 en vanilline de la solution F1 en fonction de m, V0, V1, V2 et de la masse molaire M de la vanilline (M=152,2g.mol). L'incertitude relative sur c1 est la somme des incertitudes relatives sur m,V0, V1 et V2(voir formule ci dessous).
e) En comparant les incertitudes relatives, préciser quelle est la principale source d'incertitude sur la concentration de la solution F1.
f) Déterminez avec son incertitude la valeur de c1.
g) Déduire du spectre d'absorption de la solution de sucre vaiillé la quantité ainsi que la masse de vanilline dans un sachet de 7,5g.
J'ai fait :
a) non elle n'est pas colorée car le spectre visible "va" de 400 à 800nm.
b) la loi de Beer Lambert où A=kc
c) ?
d)?
e)?
f)?
g)?
merci de m'aider 
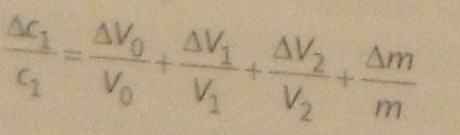

Bonjour
a) ok
b) ok
c) A cette longueur d'onde, l'absorbance est maximale ce qui signifie qu'il n'y a qu'une seule valeur d'absorbance (donc une seule valeur de concentration molaire). Si on se placait en dehors de cette  on aurait forcément deux choix possibles de A (et donc de concentration) !! D'où l'intéret de se placer à
on aurait forcément deux choix possibles de A (et donc de concentration) !! D'où l'intéret de se placer à  max ! OK?
max ! OK?
d) on a effectué ici une dilution. Tu l'as étudié en 2nde ca ! Quelle relation utilise-t-on généralement pour une dilution ?
d) C'est ce genre de relation qu'il faut utiliser ici mais attention aux chiffres utilisés ! ils doivent respectés l'énoncé de l'exo !
1ere étape : Exprime-la à nouveau avec les bons chiffres.
2e étape : Il faut que tu écrives une relation entre C0 (la concentration molaire de la solution F0) avec la masse m, le volume V0 et la masse molaire M en vanilline.
A toi de jouer ! 
Je n'avais pas vu que c'était toi Manon430 ! Décidement, on ne se quitte plus...
C'est cette relation qu'il faut utiliser ! Mais attention encore une fois aux chiffres : ca serait plutot C0=n0/V0
Exprime maintenant n0 en fonction de m et de M ! Exprime ensuite C0 en fonction de m, M et V0 !
(je risque de ne plus te répondre ce soir. On continuera demain si tu veux !)
pas besoin de remplacer les lettres par des valeurs ! On te demande seulement l'expression littérale dans la question !
Donc tu as trouvé l'expression de C0. Bon maintenant il va falloir utiliser l'expression CA VA = CB
VA = CB VB
VB
Sachant qu'on a pris V2 = 1 mL de cette solution F0 et qu'on l'a mis dans une fiole de volume V1 = 100mL
comment va-t-elle s'écrire ?
Ne va pas si loin et n'essaie pas de donner des valeurs !
Tu as remplacé C0 par m0 V0/M ok très bien puisqu'il faut que, dans l'expression finale demandée, il y ait m, V0 et M.
V0/M ok très bien puisqu'il faut que, dans l'expression finale demandée, il y ait m, V0 et M.
Mais à gauche du signe "=" tu n'as pas besoin de développer ! Laisse simplement V1 et C1 puisqu'on te demande d'exprimer C1 au final !
OK?
non ! laisse m0*V0/M*V2 à gauche du signe "=" et C1*V1 à droite ! Comme ca tu as toutes les grandeurs demandées dans la question !
Tu n'as plus, ensuite, qu'à exprimer C1 = ...
L'incertitude relative de C1 vaut :  C1 / C1
C1 / C1
Reprends l'image n°2 que tu as posté : il faudrait que tu calcules chaque quotient ( m / m,
m / m,  V2 / V2, ...) Pour cela aides-toi des incertitudes absolues (que l'on note par exemple
V2 / V2, ...) Pour cela aides-toi des incertitudes absolues (que l'on note par exemple  C) avec la 1ere image !
C) avec la 1ere image !
donc pour C1 :
désolé je ne comprends pas :/ il manque des données non ? que vaut  V0 et V0 ? pouvez vous me montrer pour C1 pour que j'essaie de faire les autres ?
V0 et V0 ? pouvez vous me montrer pour C1 pour que j'essaie de faire les autres ?
ah oui donc : 0,007e-3/0,001
et pour l'autre je dirai : 0,1e-3/0,1
c'est ça ?
et pour la question suivante s'il vous plait ?
pour le dernier tu peux 0.1/100 puisque tu divises des mg avec des mg ! Que ce soit 0.1/100 ou 0.001/0.1 ca revient au meme...
Donc maintenant compare le résultat de chaque quotient et voit lequel est le plus grand !
e) oui voila !
f) je n'ai pas vérifié mais attention tu as bien fais :  C1 / C1 pour en déduire ensuite C1 ?
C1 / C1 pour en déduire ensuite C1 ?
g) Ca tu peux le faire toute seule quand meme ! Aller réfléchi un peu ! Qu'est-ce que tu vas pouvoir faire piur en déduire la quantité de matière de vanilline ?
f) non j'ai tout additionner j'ai utilisé la formule de la photo 2 pouvez vous me détailler votre calcul ?
g) je regarde  max et je trouve 350nm pour une A=0,3 mais après je ne vois pas
max et je trouve 350nm pour une A=0,3 mais après je ne vois pas
f)  C1 / C1 = 0.4*10-3 + 0.1/100 + 0.007/1 + 0.1/100
C1 / C1 = 0.4*10-3 + 0.1/100 + 0.007/1 + 0.1/100
g) ce n'est pas tout a fait A=0.3 !! Bon et ensuite comment en déduis-tu une quantité de matière ?
f) ok
g) A=0,28 je connais beer lambert A=kc mais ici ce n'est pas une droite c'est une courbe donc je ne vois pas trop le lien :/
g) attends mais le graphe ce n'est pas A en fonction de C !!! C'est A en fonction de  donc c'est normal que ca soit une courbe !! C'est bien la loi de Beer Lambert qu'il faut utiliser (pas trop le choix en meme puisqu'il n'y a que cette relation qu'on connait...) Donc ca donne quoi ?
donc c'est normal que ca soit une courbe !! C'est bien la loi de Beer Lambert qu'il faut utiliser (pas trop le choix en meme puisqu'il n'y a que cette relation qu'on connait...) Donc ca donne quoi ?
Bonjour, excusez moi mais je ne comprend pas à la question d) pourquoi vous remplacez C0 par (m*V0)/M ? Puisque n = m/M et que C0=n0/VO C0= m/(M*V0) non ?
exact ! merci elev !
Manon430 est-ce qu'on te donne la constante k dans l'énoncé pour pouvoir appliquer la loi de Beer Lambert ?
Donc d'après la formule précédente C1*V1=C0*V0 donc C1=m/(M*V1)? les V0 se simplifient et je n'arrive pas à le retrouver dans l'expression littérale, et je ne comprend pas comment vous introduisez V2 ?
Alors il faudrait d'abord que tu traces le graphe A en fonction de C avec les différentes solutions ! Comme ca tu auras accès à la constante k !
mais je dois prendre quelles valeurs ? (je ne comprends pas comment le tracer sachant que je n'ai qu'une longueur d'onde)
aides toi ici du tableau donné dans l'avant dernière image ! Laisse tomber la longueur d'onde on s'en fiche !! Ce qui nous interesse ici ce sont les différentes A et les C données dans le tableau. Lorsque tu auras tracé la droite, pointes l'absorbance A=0.38 (celle de la solution vanillée) et tu auras accès à une concentration C ! De là tu peux en déduire une quantité de matière !
ok donc je trace la droite grâce aux données de la dernière image
une fois que j'ai k, je fais :
c=0,38/k
ensuite pour en déduire la masse comment je fais (je n'ai pas tracé la droite c'est jute la méthde que je veux)
je peux utiliser la concentration massique ?
pas besoin d'avoir la valeur de k finalement puisque tu peux te servir de la droite pour trouver directement C !
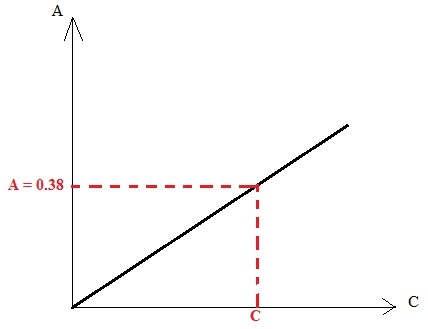
A partir de la concentration molaire C tu peux en déduire la quantité de matière n puis la masse m !
ok donc une fois que j'ai C, je fais :
C=n/V
n=C*V avec V=?
et m=n*M avec M=152,2
que vaut V par contre ?


