Inscription / Connexion Nouveau Sujet
exo chlore tableau periodique
bonjour
je debute sur le site, j'espere que je post au bon endroit...
je bute sur un exercice.
on etudie l'element chlore Cl, 3eme ligne et 7eme colonne du tableau periodique.
1) Le chlore mono-atomique existe-t-il dans la nature? expliquer, justifier.
2) quelle est la valence du chlore?
Pour etre tout a fait honnête, j'ai pas compris la question....
et autre question:
quels points communs a le magnesium avec les atomes qui sont dans la meme colonne que lui?
merci beaucoup pour votre aide, parce que la je rame...
oui je sais, j'ai l'air bete.
Je suis en daeu b donc en 7 mois on mange les 3 ans de programme bac s.
merci beaucoup, je comprend mieux les choses
cela dis, un atome mono atomique, je sais pas ce que c'est.
et merci de ne pas "te moquer" de mes questions qui doivent te paraitrent basiques...
je ne me moquerai pas, je ne me permets pas ce genre d'"idioties". Tu viens demander de l'aide, ceux qui sont c*** ne le font pas.
monoatomique ça veut dire que tu n'as qu'un atome ou un ion. Cl- est un ion monoatomique
Al est un atome monoatomique : on dit atome tout cours ou élément 
je vais compléter :
CO2 est une molécule polyatomique
Cl2 est une molécule diatomique
PO43- est un ion polyatomique
ok merci.
je pense avoir compris, je vais essayer de faire mon exo
bon avant je vais faire manger mes enfants, parce que je suis sur mes devoirs depuis 18h30, ils commencent a avoir faim... mere indigne en plus!
merci beaucoup de ton aide et quand j'ai fini, je viendrai poster mes reponses, si tu es toujours la, pourras tu me dire si j'ai bien compris?
bien sûr, dans le pire des cas ce sera demain, mais vu la combativité dont vous faite preuve je serais au rdv ce soir
donc j'ai repondu 1ere question:
non car la molecule du chlore possede deux atomes et les atomes Cl seuls n'existent pas.
2eme quetion: la valence du chlore est monovalente car il ne possede qu'une seule liaison covalente.
par contre, le point commun entre le magnesium et les autres elements de la meme colonne, la c'est un mystere pour moi!!!
a) attention le nom de la molécule c'est le dichlore (2 atome de chlore).
b) oui le chlore est monovalent, il ne peut faire qu'une liaison covalente pour compléter sa couche électronique externe et avoir la structure de l'argon 
Lorsque les atomes subissent des transformations (transformation en ion monoatomique ou lorsque qu'ils établissent des liaisons avec d'autres atomes) ils le font de façon à saturer leur couche externe.
Les atomes dont la couche externe est déjà saturée ne donneront donc pas d'ion monoatomique et n'auront pas tendance à établir de liaison avec d'autres atomes. Ils sont dits "chimiquement stables". On dit aussi qu'ils présentent une grande inertie chimique.
L'application de la règle du duet et de celle de l'octet permet de prévoir la charge et donc la formule de la plus part des ions monoatomiques. Par exemple:
Considérons l'atome de chlore de numéro atomique Z = 17 dont la formule électronique est: (K)2(L)8(M)7. Il possède 7 électrons sur sa couche externe (M). En se transformant en ion chlorure il sature cette couche externe avec un octet (8) électrons. Cet atome, initialement neutre du point de vue électrique, va donc gagner un électron c'est-à-dire une charge négative lors de sa transformation en ion chlorure. La formule de cet ion est alors: Cl-.
Une liaison covalente entre deux atomes correspond à la mise en commun entre ces deux atomes de deux électrons de leurs couches externes pour former un doublet d'électrons appelé doublet liant.
Le doublet liant, mis en commun entre les deux atomes, est considéré comme appartenant à chacun des atomes liés.
Le nombre de liaisons covalentes que peut former un atome est égal au nombre d'électrons qu'il doit acquérir pour saturer sa couche externe à un octet d'électrons (ou un duet pour l'atome d'hydrogène).
c) Chaque élément est représenté par un symbole composé d'une lettre majuscule (ex: élément iode I) ou d'une majuscule suivi d'une minuscule (ex: élément magnésium Mg).
Mendéléïev (1834-1907) eut l'idée de classer les éléments, connus à son époque, en colonnes et en lignes par ordre de masses molaires atomiques croissantes, de telle manière que les éléments figurant dans une même colonne présentent des propriétés chimiques semblables.
La masse molaire atomique est la masse d'un nombre déterminé très grand d'atomes de l'élément considéré dans un échantillon naturel.
La classification moderne comporte 7 lignes (ou périodes) et 18 colonnes. Les éléments sont rangés dans chaque ligne par ordre croissant du numéro atomique Z.
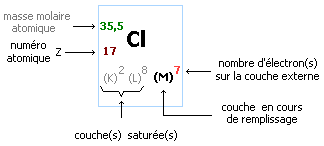
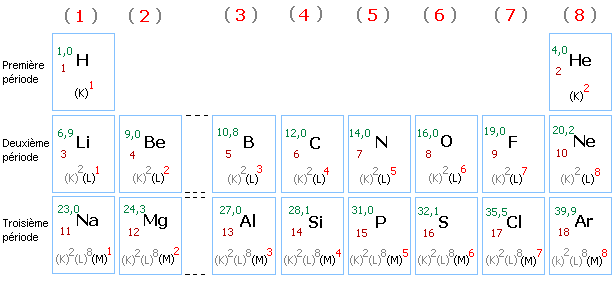
Dans une même ligne (ou période), les atomes des éléments ont le même nombre de couches électroniques occupées. Première ligne: couche K, deuxième ligne: couche L, troisième ligne: couche M.
Le parcours d'une ligne correspond au remplissage d'une couche électronique, les couches inférieures étant saturées.
Dans une même colonne, les atomes des éléments ont le même nombre d'électrons dans la couche externe. Les atomes des éléments de la colonne (1) ont 1 électron sur la couche externe, ceux de la colonne (2) en ont 2 sur la couche externe etc...
Les propriétés chimiques des atomes des différents éléments (transformation en ions monoatomiques ou capacité à établir une ou plusieurs liaisons covalentes) dépendent essentiellement du nombre d'électrons présents dans leur couche externe.
Or les atomes des éléments appartenant à une même colonne du tableau périodique possèdent justement le même nombre d'électrons dans leur couche externe.
On peut donc légitimement supposer et nous le vérifions dans la réalité que les atomes des éléments d'une même colonne ont des propriétés très semblables, même si elles ne sont pas rigoureusement identiques. On dit que les éléments d'une même colonne constituent une famille chimique.
Les éléments de la première colonne, notée (1), (à l'exception de l'hydrogène) constituent la famille des métaux alcalins.
Les éléments de la deuxième colonne, notée (2), constituent la famille des métaux alcalino-terreux.
Les éléments de la dix septième colonne, notée (7) dans la présentation réduite, constitue la famille des halogènes.
Les éléments de la dix huitième colonne, notée (8) dans la présentation réduite, constitue la famille des gaz rares (ou gaz inertes).
merci beaucoup pour toutes ces precisions, ca m'aide beaucoup a comprendre, c'est beaucoup plus complet que mes cours.

 J'essaie juste d'adapter mes explications. Je vais te donner un truc à lire :
J'essaie juste d'adapter mes explications. Je vais te donner un truc à lire : 
