Inscription / Connexion Nouveau Sujet
Exercice
Bonjour ! 
Dans un ballon de volume V=1,41L, on introduit v=60ml d'une solution d'acide éthanoique de concentration cA=5,0mol.l^-1 et une masse m=1,25g d'hydrogénocarbonate de sodium.On ferme le ballon et on le relie à un capteur de pression différentielle.
L'acide réagit avec l'hydrogénocarbonate de sodium selon le bilan :
CH3-Co2H+HCO3-  CH3CO2-+CO2+H2O
CH3CO2-+CO2+H2O
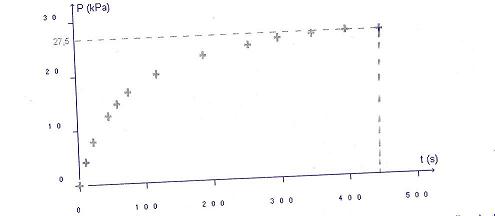
On relève la pression du gaz qui se dégage lors de cette transfomration au cours du temps.Les résultats sont regroupés dans la représentation graphique suivante.
1. Les mesure étant réalisées à  =25degrés, déterminer à partir du graphique, la quantité de matière de Co2 apparue en fin d'expérience.
=25degrés, déterminer à partir du graphique, la quantité de matière de Co2 apparue en fin d'expérience.
P =27500Pa
V =1,4.10^-3m^3
R=8,31
T =25+273
nCO2 =PV/ R.T
nCO2 =(27500.1,4*10^-3)/ 8,31.298
nCO2 =1,5.10^-2 mol
2.Déterminer les quantités de matière initiales de réactifs
quantité de matière de l'acide éthanoique: n=c*v
n=5,0*0,060
n=0,3mol
Quantité de matière de l'hydrogénocarbonate de sodium :
n=m/M
M=61g.mol^-1
n =1,25/61 =0,02mol
3.Dresser le tableau d'avancement e la transformation en y faisant figurer que les informations concernant l'acide,l'hydrogénocarbonate de sodium et le dioxyde de carbone. En déduire l'avancement maximal,le réactif limitant et la quantité de matière maximale de C02 ( comparer au résultat expérimental)
. L'équation de réaction est déjà équilibrée
état initial CH3-CO2H 0,3mol
état initial HCO3- 0,02mol
Etat intermédiaire CH3-CO2H 0,3-x
Etat intermédiaire HCO3- 0,02-x
Avancement maximal : x =0,02
Le réactif limitant est l'hydrogénocarbonate de sodium
la quantité de matière de CO2 formé est de 0,02 mol ??
4. Quelles seraient les allures des courbes représentant la pression en fct du temps dans les cas suivants :
* C'A=3,0mol.L^-1 et  =25degrés
=25degrés
* C''A=3,0mol.L^-1 et  =20degrés
=20degrés
Je ne vois pas trop là ... :/
Merci beaucoup
Salut Lunie ! Ravi de te retrouver après ces vacances estivales ! 
1)2) Très bien !
3) Oui ! La quantité max de CO2 qui peut etre dégagée vaut n=0.02 mol !
4) Il faut que tu recalcules la pression de CO2 à l'état final ! L'allure sera forcément une exponentielle mais P(CO2) finale sera différente de celle de la courbe donnée !
OK?
Bonsoir Lulu3324, Merci beaucoup, moi aussi ça me fait plaisir!
Merci de m'avoir répondu ; ))
4) pour le cas 1 je trouve P =35376PA ???
EDIT : Oui, c'est pas possible que ce soit ça car j'utilise même pas la donnée c=3,0mol.L^-1 ...
Je ne suis pas sûre de bien comprendre l'expérience ..
En fait pour le cas 1 on ne se sert pas de C' étant donné que l'avancement max est dicté par la quantité de matière de l'hydrogénocarbonate ! Donc ca sera la meme allure !
Bonsoir ! 
J'ai faux mon tableau car je n'ai pas pris en compte le SODIUM dans hydrogénocarbonate de sodium ...
Pour les courbes, Je sais que si on augmente la température, la vitesse d'agitation des molécules augmente et donc la vitesse de réaction augmente.
C'A =3,0mol.l^-1 et 25degrés
Même température que la courbe C ( image que j'ai posté dans mon 1er post )
Donc c'est la même courbe? Peut-importe la quantité de matière ?
je me "replonge " dans cet exo que maintenant, du coup je me rappelle plus trop , ça doit pas très dur pourtant ...
merci
Pourquoi ton tableau sert-il faux ??? Les ions Na+ sont spectateurs...
Cas 1 : Le réactif limitant n'a pas changé. Donc meme courbe !
Cas 2 : Effectivement la température influe ! La courbe sera donc de meme nature mais il faut la dessiner en dessous de celle donnée car la pression à l'état final sera plus faible que pour le cas 1 !


