Inscription / Connexion Nouveau Sujet
Enthalpie de formation
Bonjour à toutes et tous, j'espère que tout le monde va bien en cette période particulière.
Special hurry up à Gbm et Odbugt1 pour leur dernier soutien.
J'ai un petit exercice sur les enthalpies à faire. Comme les formules sont composées de lettres grecques et que je ne sais pas les reproduire ici, je vous propose de joindre en fichier toute partie du texte comprenant lesdites lettres:
Début de la question: à l'aide des enthalpies de formation, montrer que l'enthalpie de combustion du butane vaut: fichier 1
Voici le début de mon calcul: fichier 2
Voilà. Je voulais savoir si j'étais sur la bonne voie.
Merci d'avance
Bonne journée
Yann
** image supprimée **
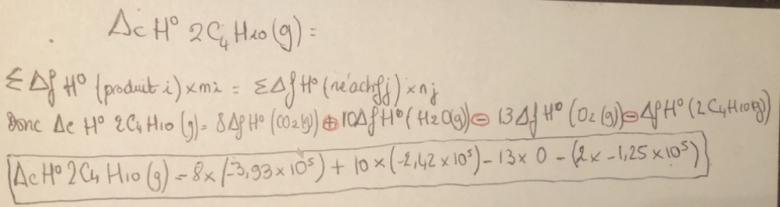
Bonjour Yann,
Tu es matinal !
Concernant les lettres grecques nécessaires pour les données, tu peux les faire facilement :
Je te laisse me recopier les données fournies pour que je les ajoute sur ton sujet initial.
Ensuite, on peut effectivement tolérer pendant le confinement les propositions manuscrites, mais à la condition suivante : ![]() [COVID-19] Assouplissements jusqu'à FIN JUIN
[COVID-19] Assouplissements jusqu'à FIN JUIN
Pourrais-tu déjà nous écrire l'équation-bilan de la combustion du butane (complète j'imagine) ?
Bonjour Gbm!
Oui je suis matinal car je dois coder et faire des devoirs en maths et en ETT.
Je vous recopie l'énoncé :
Montrer que  cHo= -2,9x106 J.mol-1.
cHo= -2,9x106 J.mol-1.
L'eau formée est liquide à 25 degrés.
Est-ce bon?
Yann
Vu le temps consacré au codage, je sens une filière d'études pour l'année prochaine 
OK et tu n'as pas les autres enthalpie standards de formation ?
Et quid de l'équation-bilan de la combustion du butane ?
Oui Gbm, je suis en Sti2d option sin mais paradoxalement je veux m'orienter vers des études de son. Pour l'instant c'est compliqué... mais vaut mieux tard que jamais !
Alors, l'équation bilan est:
2C4H10 (g) + 13 O2 (g) 8CO2 (g) + 10H2O (g)
8CO2 (g) + 10H2O (g)
Concernant les autres enthalpies de formation, voici ce que j'ai :
Je sais que l'enthalpie de formation du butane est:
Butane C4H10 (g)=-1,25 x 105
Yann
C'est encore jouable en terminale à mon sens, mais il va falloir s'accrocher  .
.
Si je commence par l'équation-bilan : 2C4H10 (g) + 13 O2 (g) 8CO2 (g) + 10H2O (g)
8CO2 (g) + 10H2O (g)
Bilan côté réactifs :
* 2*4 = 8 atomes de C
* 2*10 = 20 atome d'H
* 13*2 = 26 atomes d'O
Bilan côté côté produits :
* 8 atomes de C => ok
* 10*2 = 20 atomes d'H => ok
* 8*2 + 10 = 26 atomes d'O => ok
L'équation est donc bien équilibrée !
Ensuite, calculons l'enthalpie standard de la réaction :
Il manque donc un coefficient stoechiométrique dans ta proposition manuscrite.
Ensuite, cette expression se simplifie effectivement pour un corps pur simple.
Excuse moi Gbm mais je ne trouve pas. Je reste bloqué sur le problème du manque d'un coefficient.
Yann
Bonjour gbm
Juste un détail concernant les notations actuellement utilisées en thermodynamique chimique : comme le fait très bien Yann93230, une enthalpie standard de formation se note  fH° et non
fH° et non  rH°f
rH°f
C'est un détail bien sûr mais autant harmoniser les notations : la thermo est déjà bien assez difficile comme cela ! 
Bonjour vanoise,
Bonjour gbm
Juste un détail concernant les notations actuellement utilisées en thermodynamique chimique : comme le fait très bien Yann93230, une enthalpie standard de formation se note
 fH° et non
fH° et non  rH°f
rH°fC'est un détail bien sûr mais autant harmoniser les notations : la thermo est déjà bien assez difficile comme cela !

Au temps pour moi, je n'avais pas conscience que mes notations sont désuètes : mon dieu, je suis "has been", je prends un coup de vieux
 .
.@Yann :
Je corrige donc mes notations
En fait ton application numérique semble correcte, c'est juste qu'il manque dans ton expression littérale le coefficient stoechiométrique que je t'ai mis en rouge (tu avais écrit


Merci Gbm (et Vanoise pour l'observation)
Donc après je mets mes valeurs... là j'ai un cours d'ETT qui commence donc je fais ça dans l'après-midi...
Quand je parle de valeurs ce sont les enthalpies de formation du CO2, du H2O, du O2 qui sera zéro et du butane.
On se suit jusque là ?

Yann
Je t'en prie, cette exercice m'aura permis de me remettre à la page en thermochimie  .
.
Oui c'est bien cela, le dioxygène étant un corps pur simple, son enthalpie standard de formation peut être considérée comme nulle.
Bon cours d'ETT et à plus tard !

Bonjour Gbm,
Non je n'oublie pas mais je devais finir une requête en informatique et je bloque... y a grosse pression ! 
Je m'en suis arrêté à :
 cHo 2C4H10 (g) =
cHo 2C4H10 (g) =
8(-3,93x105) + 10(-2,42x105) - 13x0 - 2(-1,25x105)
Pfiouuuuu....
C'est bon?
Yann
ça marche !
N'oublie pas ce que odbugt1 t'avais inculqué (je suis sûr qu'il a eu des frissons à l'instant) : il faut préciser l'unité à un résultat.
En dehors de ça, cette application numérique me semble bien partie

Ok!
J'ai un visio cours à 16h (continuité pédagogique) et je m'y remets mais hier j'ai commencé les calculs et.... je n'y arrivais pas avec ma calculatrice (la TI 82).
@ tout à l'heure
Yann
Bonsoir Gbm!
Voici mes calculs:
8(-3,93x105)= -3 144 000
10(-2,42x105)= -2 420 000
13x0=0
Total: 5 564 000
Bon ok mais 2(-2,9x106 = 5 800 000
Donc.... problème !
Je ne vois pas où j'ai raté le coche 
odbugt1 a eu un double frisson : les unités  ?
?
Si je te fais confiance pour les valeurs des enthalpie standard de formation (message du 29-04-20 à 15:34) :
Sorry pour l'oubli des unités. Je veux aller trop vite parfois...
Je vous redonne le texte exact de l'énoncé : à l'aide des enthalpies de formation montrer que l'enthalpie de combustion du butane est :  cHo= -2,9x106J.mol-1
cHo= -2,9x106J.mol-1

Bonjour Yann,
Après une bonne nuit de sommeil, j'ai compris notre erreur :
l'équation-bilan de la réaction de combustion du butane est 2C4H10 (g) + 13 O2 (g) 8CO2 (g) + 10H2O (g)
8CO2 (g) + 10H2O (g)
Pour simplifier, l'enthalpie de cette réaction, c'est l'énergie libérée lors de la combustion d'1 mole de butane.
Il faut donc faire le calcul sur la base de cette équation-bilan :
C4H10 (g) + 13/2 O2 (g) 4CO2 (g) + 5H2O (g)
4CO2 (g) + 5H2O (g)
D'après la loi de Hess (c'est le petit nom de cette formule) :
Application numérique : j'ai vérifié sur le net, il faut que tu prennes les valeurs des enthalpies standards de formation à T = 298K :
Remarque : on obtient bien une réaction exothermique, elle libère de l'énergie.
Cela vérifie également l'expression... la nuit porte conseil! 
Donc au final, vous avez tout « divisé » par deux. Par contre pourriez-vous me réexpliquer cette petite information :
Il faut que tu prennes les valeurs des enthalpies standards de formation T=278K?
Merci d'avance
Yann
Attention, j'ai écrit T = 298K
L'énoncé te précise ceci :
L'eau formée est liquide à 25oC
Donc T = 25 + 273 = 298K

Oui, excusez-moi ! 298K
Mais... Gbm, je ne comprends toujours pas pourquoi cela change la donne. Il y a quelque chose qui m'échappe...
Yann
Il faut en revenir à la notion même : l'enthalpie des composés chimiques intervenant dans la réaction dépend de la température à cause des capacités thermiques de ces corps. Tu verras cela plus en détails si tu fais de la thermochimie dans tes études supérieures.
Plus simplement en ce qui nous concerne, c'est parce que l'énoncé a précisé que la température à considérer est 25°C, on prend donc les enthalpies standards de formation dans les conditions imposées par l'énoncé.
Ok Gbm!
En tout cas, une fois de plus, merci beaucoup pour cette aide précieuse. Merci pour votre patience et votre pédagogie qui me rabibochent avec cette matière pas toujours facile à comprendre.
Je pense que l'on va être amenés à se revoir car.... j'ai un TP maison à faire (combustion de la bougie  ). Mais avant, je vais essayer de le faire seul.
). Mais avant, je vais essayer de le faire seul.
Auriez-vous des liens comme ceux précédemment envoyés qui sont très clairs et précis ?
Merci encore !
Yann
Je t'en prie, c'est l'objectif de ce forum  .
.
Alors je n'ai malheureusement pas encore de fiche à te proposer là-dessus car elle est en cours de rédaction : nous sommes en plein chantier de restructuration des ressources du site suite à la réforme Blanquer, ça prend du temps mais on avance : toutes les fiches de seconde sont à jour et on en est à la moitié sur la classe de première.
De manière générale, si tu recherches une ressource disponible, c'est par ici : ![]() Des fiches de COURS, rien que pour vous !
Des fiches de COURS, rien que pour vous !




