Inscription / Connexion Nouveau Sujet
Concentration des ions en solution
Bonjour
Je viens de finir un exercice et de voir la correction du manuel de celui-ci, mais ne la comprends pas. Le voici :
On dispose de plusieurs solutions aqueuses de concentration en soluté apporté c=0,50mol/L réalisées par dissolution de divers solutés.
Nom et formule des solutés :
Hydroxyde de sodium NaOH
Chlorure de cuivre (II) CuCl2
Sulfate de baryum BaSO4
Nitrate d'argent AgNO3
1) Écrire l'équation de dissolution du solide ionique pour chacune des solutions.
2) pour chacune des solutions calculer la concentration des ions dans les solutions.
Je vous mets en photo mes équations (ce serait incompréhensible si je les écrivais ici) mais vous recopie mes calculs pour la 2).
1) photo
2) [Na+] = [OH-]= c =0,50 mol/L
[Cu2+] = c = 0,50 mol/L et [Cl-] = 2c = 2*0,5 = 1 mol/L
Jusque là, j'ai la même chose que la correction
[Ba4+] = c = 0,5mol/L et [SO-] = 4c = 4*0,5 = 2 mol/L
Enfin, [Ag3+] = c = 0,5mol/L et [NO-] = 3c = 3*0,5 = 1,5mol/L
Sauf que ces deux derniers calculs ne sont pas les mêmes que la correction, car ces 2 mêmes équations ne le sont pas non plus, et je ne vois pas en quoi j'ai faux … (je joins aussi la correction des équations et calculs)
Merci beaucoup de votre aide ! 

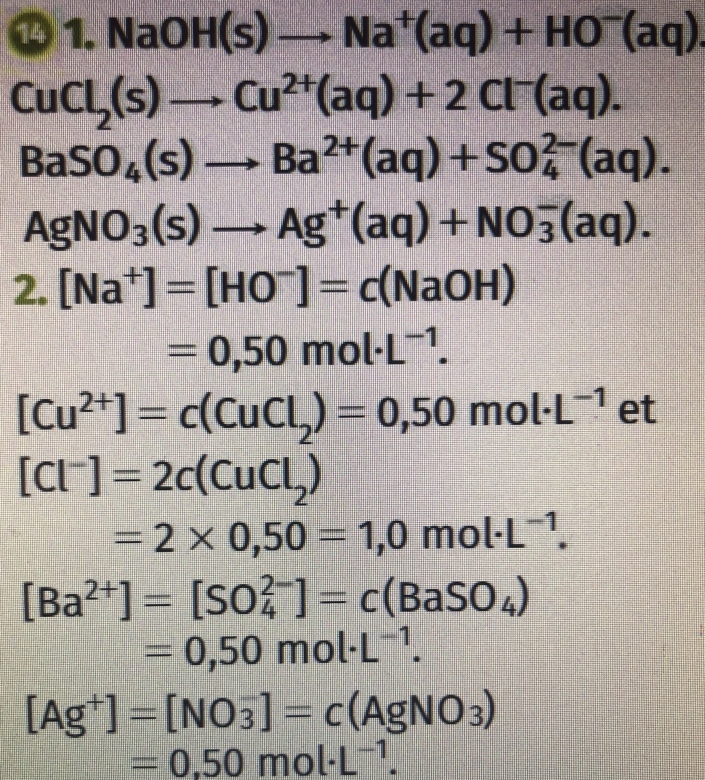
Bonjour,
Je viens de regarder la correction, elle est correcte.
Tu as fait une erreur sur la troisième équation : l'ion sulfate est et l'ion baryum
(il faut connaître par coeur les formules de principaux ions :
![]() Tests de reconnaissance des principaux ions)
Tests de reconnaissance des principaux ions)
L'équation de dissolution est donc bien
Donc 1 mole de dissoute, il se forme 1 mole de
et 1 mole

Merci beaucoup pour votre réponse ! Mais je ne comprends pas pourquoi, par exemple, à la 3ème équation on ne met pas « 4SO- » alors qu'à la 2ème, comme je l'ai fait, on met « 2Cl- » Et non « Cl2-»

Et c'est la même chose pour la 4e équation … je ne comprends pas pourquoi ce n'est pas le même « procédé » que les deux premières équations
Merci beaucoup pour votre réponse ! Mais je ne comprends pas pourquoi, par exemple, à la 3ème équation on ne met pas « 4SO- » alors qu?à la 2ème, comme je l?ai fait, on met « 2Cl- » Et non « Cl2-»

Attention ! Il ne faut pas inventer des ions : as-tu vu en cours la tendance naturelle ions à respecter la règle du duet et de l'octet en seconde ?
Tu as fiche de première avec un rappel ici (clique sur la maison) :
A la lumière de ces fiches, tu comprendras que les ions Cl2- et SO- ne sont pas possibles

Oui, en effet j'ai vu ces règles mais même en relisant le cours sur la fiche je ne vois pas le rapport avec cet exercice 
Pourtant il y a un lien ...
Cela permet d'expliquer que l'ion chlorure ne peut être que Cl- en vertu de cette règle (tu peux t'amuser à appliquer la règle de l'octet).
Donc on a bien l'équation de dissolution CuCl2 --> Cu2+ + 2Cl-, soit
[Cu2+] = C(CuCl2)
et [Cl-] = 2C(CuCl2)
Puis idem pour l'ion sulfate, sa formule est SO42- en vertu des règles de stabilité, donc pour respecter le principe de conservation de la masse et de la charge :
BaSO4 --> Ba2+ + SO42-
soit [Ba2+] = C(BaSO4)
et [SO42-] = C(BaSO4)
Pour la 4ème équation c'est pareil, il faut connaître les formules des principaux ions, en vertu de la règle de stabilité.
Tu également une fiche de cours sur le site là-dessus (regarde l'application à la fin) : ![]() [lien]
[lien]
Merci pour votre reponse, je n'ai pas encore saisi le lien avec ces règles mais bon ça va venir à force de faire des exercices ..
Bonne soirée 
Je t'en prie mais persévère !
Si je dois te donner une méthode générale :
Etape 1 : connaître par coeur les formules des principaux ions : ![]() Tests de reconnaissance des principaux ions
Tests de reconnaissance des principaux ions
Etape 2 : dès que tu as un composé ionique, tu seras en mesure de déterminer directement les ions en jeu
Exemples :
KMnO4
* l'ion permanganate est MnO4-
* l'ion potassium est K+
CaCl2
* l'ion calcium est Ca2+
* l'ion chlorure est Cl-
Etape 3 : en vertu du principe de Lavoisier (rien ne se perd, ...) tu il faut équilibrer ton équation en masse (tu sais le faire depuis le collège) et en charge :
Immédiatement on constate que la charge positive de K+ est compensée par la charge négative apportée par l'ion MnO4- :
KMnO4 --> K+ + MnO4-
En revanche, pour le deuxième cas, l'ion calcium apporte deux charges "+" quand l'ion chlorure n'apporte qu'une charge "-", il faut donc doubler la quantité d'ions chlorure pour que l'équation soit équilibrée en charge :
CaCl2 --> Ca2+ + 2Cl-
Tu également une fiche de cours sur le site là-dessus (regarde l'application à la fin) : ![]() [lien]
[lien]
Bonne soirée,

Je viens de saisir pour les règles du duet et de l'octet ! Merci beaucoup pour vos réponses j'ai enfin compris ! 


