Inscription / Connexion Nouveau Sujet
Cinétique chimique
Bonsoir, j'ai besoin d'aide avec cet exercice si possible :
Hydrolyse du saccharose :
Le saccharose s'hydrolyse dans l'eau en glucose et fructose, selon la réaction d'équation :
C12H22O11(aq) + H2O (l) → C6H12O6 (aq) + C6H12O6(aq)
On suit l'évolution temporelle de la concentration C en saccharose d'une solution :
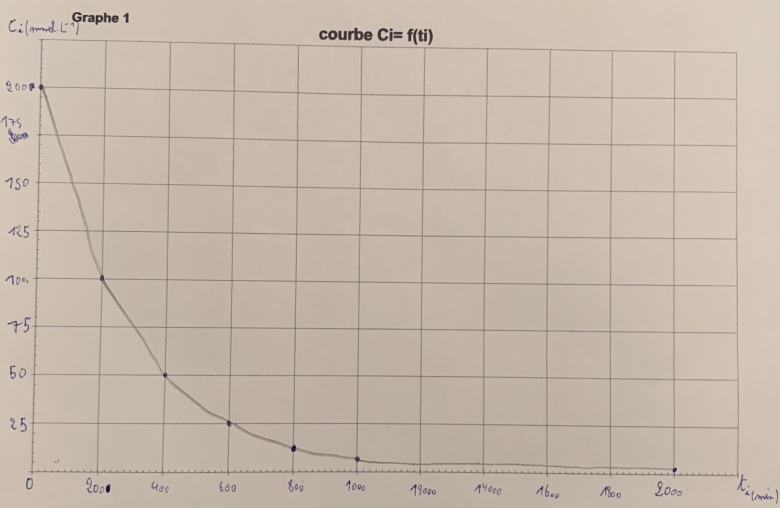
| ti(min) | 0 | 200 | 400 | 600 | 800 | 1000 | 2000 |
| Ci (mmol.L-1) | C0=200 | 100 | 50 | 25 | 12,5 | 6,3 | 3,1 |
| Vi(....) | |||||||
| Ln(Ci/C0) |
1)Tracer la courbe Ci= f(ti) sur le document réponse graphe1
2) Déterminer le temps de demi-réaction t1/2.
3) Cette réaction se produit à une température T. Comment évoluerait le temps de demi-réaction t1/2 si la réaction se produisait à une température T' > T ? Justifier.
4) Déterminer graphiquement les vitesses volumiques vi de disparition du saccharose
aux instants ti =0; 200; 600 et 800min.
5) Déterminer les vitesses volumiques vi de disparition du saccharose à partir du tableau 1 et compléter la ligne 3. On indiquera l'unité de vi.
D'où peuvent provenir les différences avec les valeurs obtenues à la question 4) ?
6) Tracer le graphe vi = f(Ci) sur le document réponse graphe 2 et conclure en justifiant sur l'ordre de la réaction par rapport au saccharose.
7) Pour ti compris entre 0 et 1000 min, calculer ln(Ci/C0). Compléter la quatrième ligne du tableau 1.
8)Tracer la courbe ln(Ci/C0) = f(t) sur le document réponse graphe3. Conclure.
9) On suit l'évolution temporelle de la concentration C en saccharose d'une solution dont la concentration initiale est le double
C0 = 400 mmol.L-1.
| ti(min) | 0 | 200 | 400 | 600 | 800 | 1000 | 2000 |
| Ci (mmol.L-1) | 400 | 200 | 100 | 50 | 25 | 12,5 | 6,2 |
Pour cette nouvelle concentration initiale, tracer le graphe Ci= f(ti) et conclure.
10) Qu'est-ce qu'un catalyseur ?
Donc si je comprend bien, je commence par faire le graphe1 avec en ordonnée les valeur du tableau Ci et en abscisses les valeurs du tableau ti(min) ? Je trace sans règle ?
Ensuite pour la question 2) je cherche tf et en ordonnée je cherche tf/2 (par exemple si tf se trouve à 10cm de l'origine en y=0, tf/2 se trouve à 5cm ?) puis une fois tf/2 trouvé, je vais jusqu'à la courbe pour trouver l'abscisse t1/2 ?
Le premier tableau peut se remplir directement ou il faut faire les questions ? (Je pense qu'il faut faire les questions 4 et 8 avant...)
Je ne sais pas à quoi correspond ln(Ci/C0) je vois ln dans mon cours mais il ne l'explique pas
Merci d'avance

Ah non pardon : plutôt on cherche tf en ordonnée
On divise tf par 2 puis on trouve sur l'axe des abscisses t1/2 ?
Bonjour
Le temps de demie réaction est la durée nécessaire pour passer de c=Co à c=Co/2.
Il faudrait que tu scannes et postes ici les courbes obtenues.
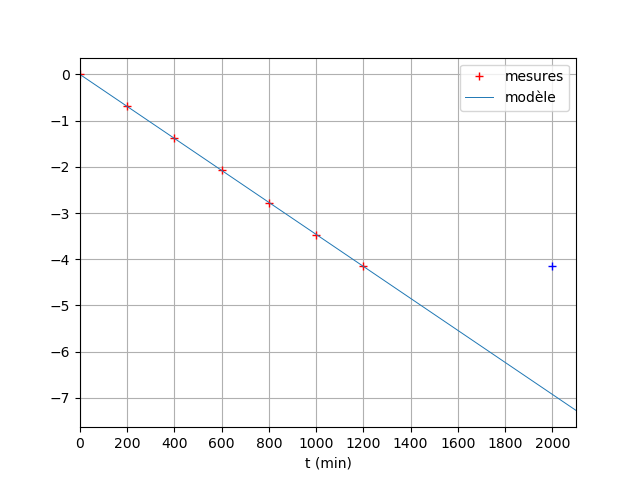
Il y a manifestement une erreur dans tes tableaux de mesures. Le dernier point de mesure ne correspond pas à t=2000min mais à t=1200min.
Non c'est bien 2000
Il y a bel et bien une erreur d'énoncé : essaie de réfléchir un peu en faisant preuve d'un minimum d'esprit critique : en regardant la série de points de mesure, on constate que la concentration est divisée par 2 toutes les 200min . Le passage de 6,3mmol/L à la moitié (3,1mmol/L environ) doit aussi avoir une durée de 200min !
Autre preuve de cette erreur : il suffit de tracer la courbe ln(Ci/Co) en fonction de t : tous les points sont alignés sauf le dernier ; tout rentre dans l'ordre en remplaçant t=2000min par t=1200min.
Ça ne serai pas parce que pour arriver à tfinal le temps de la réaction est plus lent ? Car mon professeur n'a pas parlé de cette erreur ?
Une faute de frappe sur un traitement de texte : cela peut arriver à tout le monde et il se peut très bien que ton professeur vous ait donné cet exercice sans se donner la peine de le faire lui-même avant...
Je viens de demander à mon professeur pour être sur et il m'a répondu qu'il n'y a pas d'erreur, c'est bien 2000... Donc je ne comprend pas
C'est le troisième graphe qui permet le mieux de se rendre compte de l'erreur d'énoncé sur la valeur de t du dernier point de mesure. Pour ton graphique : là aussi le dernier point est mal placé mais il faut quelques notions sur les exponentielles pour s'en apercevoir.
Je comprend mais j'ai dis au professeur ce que vous m'avez dit mais il m'a dit qu'il n'y avait aucune erreur donc si je change je risque de perdre des points... Il n'est pas possible de faire l'exercice avec ça ?
Trace la courbe ln(C/Co)=f(t) et tu verras... Pour ne pas vexer ton professeur, tu as toujours la possibilité de garder les mesures de l'énoncé et de préciser que le dernier point correspond à une mesure aberrante ; tu réponds donc aux questions posées sans prendre en compte le dernier point.
As-tu étudié en cours de math les notions d'exponentielle et de logarithme népérien ? Si la réponse est non : cet exercice n'est manifestement pas adapté à ton niveau... Quelques mots tout de même...
Tu as peut-être étudié les loi de décroissance radioactive en physique. Il y a une forte analogie. Ici la concentration C décroit exponentiellement : cela veut dire qu'elle est divisée par deux à intervalle de temps constant : elle passe de 200 à 100mmol/L en 200min, puis de 100 à 50mmol/L pendant les 200min suivantes et ainsi de suite, sauf pour les deux derniers points : elle passe de 6,3 à 3,1mmol/L en 1000min et non en 200min : cela est aberrant : logiquement le passage de 6.3 à 3,1mmol/L doit s'effectuer en 200min soit entre 1000 et 1200min. J'ai tracé la courbe C=f(t) ci-dessous : on voit bien que le point de coordonnées(1200min, 3,1mmol/L) est sur la courbe et pas le point (croix bleu) de coordonnées(2000min,3,1mmol/L) même si l'écart n'est pas très spectaculaire.
Voir cours de math : l'équation d'une telle exponentielle est de la forme :
C=Co.e(-k.t)
Voir cours de math : le logarithme népérien du rapport (C/Co) doit vérifier :
ln(C/Co)=-k.t
Les calculatrices scientifiques possède une touche "ln" permettant d'obtenir le logarithme népérien. Si on représente les points d'abscisses t et d'ordonnées ln(C/Co), on doit obtenir des points alignés le long d'une droite passant par l'origine du repère. Et là : l'erreur d'énoncé apparaît de façon flagrante : la petite crois bleue de coordonnées (2000min, ln(3,1/200)) n'est abscolument pas aligné avec les autres. Pas de problème en revanche pour le point de coordonnées (1200min,ln(3,1/200)).
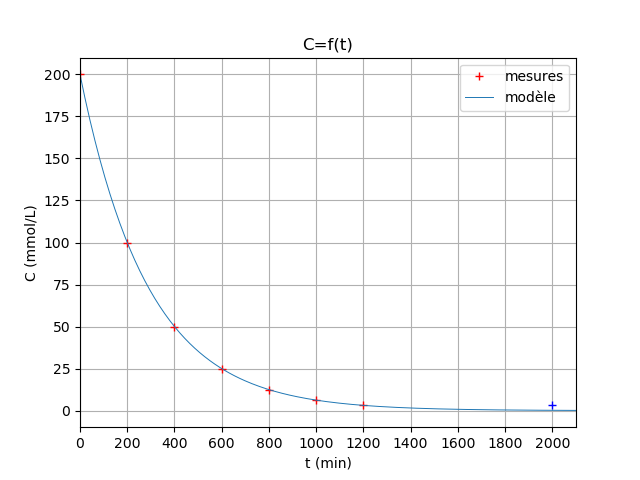
D'accord merci, mais regardez la question 7, dans tout les cas je ne devais pas faire apparaître sur le graphique 1200 ou 2000 ?
Dans la tableau je dois mettre :
| ti(min) | 0 | 200 | 400 | 600 | 800 | 1000 | 2000 |
| Ci (mmol.L-1) | C0=200 | 100 | 50 | 25 | 12,5 | 6,3 | 3,1 |
| Vi(....) | |||||||
| Ln(Ci/C0) | 0 | -0,69 | -1,39 | -2,08 | -2,77 | -3,46 |
-dois-je faire apparaître les calculs sur la copie ?
-combien de chiffre après la virgule ?
-Et les résultats sont correctes ?
-meme si c'était bien 1200 à la place de 2000, je ne dois pas mettre le résultat ?
Tes calculs de logarithmes sont corrects ; arrondir à 3 chiffres significatifs est corrects. Vérifie par toi-même que le dernier point de mesures est aligné avec les autres pour t= 1200min, pas du tout pour t= 2000min. Tu peux aussi parler de la diminution exponentielle de la concentration en fonction du temps : c est divisée par 2 toutes les 200min : il n'y a aucune raison pour que cette loi, vérifiée jusqu'à t=1000min, cesse brutalement d'être vérifiée pour t >1000min.
Alors pourquoi la question 7 dit jusqu'à 1000 ? Si on ne doit mettre que les résultats jusqu'à 1000 c'est qu'il ne faut mettre que les points jusqu'à 1000 par contre je peux prolonger la droite ?
Je n'avais pas fait attention à cette limitation. Cela semble indiquer que ton professeur s'est rendu compte d'une erreur sur le dernier point de mesure mais qu'il a été incapable de rectifier en remplaçant 2000 par 1200. A toi de voir si tu dois lui indiquer le correctif...
C'est correcte si pour la courbe Ln(Co/C0)=f(t) j'ai fait comme la vôtre mais que je n'ai pas mis les 1200 et 2000 ?
D'ailleurs pour la première courbe je dois prolonger ?
Soit tu supprimes le dernier point de mesure pour la totalité des questions, soit tu conserve le dernier point en remplaçant t=2000min par t=1200min en expliquant la raison de cette modification.
D'accord merci... Donc pour reprendre dans l'ordre (car je commence à me perdre)
Pour la 1) c'est le graphique (sauf que j'ai oublié de prolonger et il faut mettre 1200)
Maintenant la 2) comment dois-je faire ?
Pour 2 : j'ai répondu dans mon message du 18-11-20 à 10:36 .
Pour 3 : c'est un simple résultat de cours. Revois attentivement ton cours sur la cinétique chimique.
Graphiquement on trouve 200, ou il suffit de faire 200/2=100 qui correspond dans le tableau à 200min
Pour la 3) le temps de demi réaction si T'>T (ce qui signifie que la température augmente) serait plus court ? Il serait plus à gauche en abscisse ?
Ok pour le temps de demie réaction.
Ok pour le rôle de la température. Augmenter celle-ci augmente la vitesse de réaction donc diminue le temps de demie réaction.
Cela aussi doit être dans ton cours : la vitesse de réaction se définit par :
Graphiquement, la vitesse de réaction est donc l'opposé du coefficient directeur de la tangente à la courbe C=f(t) que tu as tracée...
Les points de mesures étant assez espacés, la méthode ne va pas être très précise... Tu obtiendrais peut-être de meilleurs résultats en utilisant la courbe que je t'ai fournie à 11h54....
Donc je dois tracer la tangente aux point qui ont pour abscisses 0, 200, 600 et 800 ? Et calculer le coefficient directeur de chacun d'entre eux ?
J'ai essayé pour le point à t=600min
Je prend 2 points : A(0;84) et B(600;25)
600-0/25-84=-10(environ, je ne mets que 2 chiffres significatifs ?)
L'ordonnée a l'origine est 84 (environ)
Donc y=-10x+84
Trouvez-vous à peu près pareil ?
Que dois-je faire ensuite avec ce coefficient directeur ?
Seul le coefficient directeur est utile ; ton calcul conduit donc à une vitesse v=10???? pour t=600min. Evidemment, il faut préciser l'unité. Tu n'aurais pas par hasard permuté abscisse et ordonnée ?
La concentration étant mesurée en mmol.L-1 et la durée en min, l'unité de vitesse de réaction est ici :
mmol.L-1.min-1.
Attention au signe comme expliqué déjà : ; la vitesse est toujours positive, égale à l'opposé du coefficient directeur de la tangente à la courbe C=f(t).
Sinon, ton ordre de grandeur est correct mais il y a sans doute moyen de faire un peu plus précis mais seulement un peu : ne pas fournir plus de deux chiffres significatifs. Personnellement, j'obtiens pour t=600min : V=8,7.10-2mmol.L-1.min-1.
Personnellement, j'ai plutôt, à t=0 : V=0,70mol.L-1.min-1.
C'est vrai que les points de mesures pour tracer la courbe C=f(t) sont assez espacés. Avant de tracer les tangentes, essaie à la main de tracer l'allure de l'exponentielle passant par les points, un peu comme cela a été fait par le logiciel qui a permis le tracé des courbes de mon message du 19-11-20 à 11:54. Tu gagneras en précision.
C'est à dire tracer l'allure de l'exponentielle ?
À t=800
En prenant les points A(0;50) et B(800;12,5)
V=800-0/12,5-50=21,3 mmol.L^-1.min^-1
Tu as les bons ordres de grandeurs. Essaie de placer ces points pour obtenir le graphe n° 2 ; tu devrais obtenir des points sensiblement alignés le long d'une droite passant par l'origine du repère.
Tu ne m'as pas répondu sur tes connaissances mathématiques sur les exponentielles et les logarithmes. La courbe n° 3 permet d'écrire :
avec k : constante.
Cela permet d'obtenir l'équation de la courbe C=f(t) :
As-tu vu en math comment calculer la dérivée de C par rapport à t et ainsi d'obtenir l'expression théorique de la vitesse :
?
Tout cela me parait plutôt du niveau (bac+1)...
En math j'ai seulement vu les exponentielle(enfin plutôt la dérive d'une exponentielle c'est tout) pas logarithme
Il n'y a pas une formule pour calculer Vi à l'aide des données du tableau ?
Salut, Liloo il se trouve que j'ai le même sujet de DM que toi à rendre, pour la question 5 à laquelle ou tu es bloqué, j'ai appliqué la formule [R]i+1-[R]i/ti+1-ti et tu devrais trouver des valeurs proches de celles que tu as trouvé grâce à la courbe. Par exemple pour v(t=0) = 100-0/200-0 = 0.5 mmol.L^-1.min^-1. J'espère qu'on pourra s'entraider pour le reste 
La méthode préconisée par ExHal consistant à écrire que la vitesse instantanée à la date ti est égale à la vitesse moyenne entre les instants de dates ti-1 et ti+1 est une assez bonne approximation quand les dates de mesures sont rapprochées ou quand la courbe est assimilable à une branche de parabole. La courbe est ici une exponentielle et cette méthode est ici très imprécise... Mais bon : si la notion de dérivée d'une exponentielle n'est pas à ton programme, difficile de faire autrement. Je te fournis quand même le résultat mathématique rigoureux :
Avec :
Soit :
Tu obtiens les vitesses tout simplement en multipliant les concentrations du tableau de mesures par k et k est le coefficient directeur de la droite correspondant au graphe n°3.
Personnellement pour les questions 6,7,8 et 9 je suis totalement perdu. A la question 6 pour ce qui est des échelles et des mesures ( qui ne sont pas très précises pour vi ) mais c'est la seule méthode qu'on ait vu, pour tout ce qui est Ln (Ci/C0) je ne comprends strictement rien sans mentir, si on pourrait m'éclaircir sur ces 4 questions ci, je vous en serai très reconnaissance. Merci à vous
Si on met de côté l'erreur sur le dernier point de mesure, ce problème est intéressant s'il est destiné à des élève ayant étudié en cours de math les propriétés des logarithmes et des exponentielles. Si ce n'est pas le cas (normal en terminale) ce problème est inadapté...
J'ai résumé la situation dans mes messages du 20-11-20 à 19:09 et du 20-11-20 à 23:01 mais sans cours de math sur le sujet...
La méthode de la vitesse moyenne introduit ici une erreur systématique par excès de 25% et ne permet pas d'obtenir la vitesse pour le premier et le dernier point de mesures mais bon : faute de mieux...