Inscription / Connexion Nouveau Sujet
TP - Esterification
Bonjour à tous je suis bloqué presque partout. Au 1.2) 1,3,4,5,6. Au 3.1) 1, 5 et les autres pas sur du tout. Pas sûr pour le 3.3. Et je galère au 3.4 à tout.
Pouvez vous m'aider s'il vous plaît c'est pour le 28/09/2015
Bonjour à vous deux, on parle bien de recopier l'énoncé avec les questions, pas de renvoyer à un lien ou à le poster sous forme d'image 
Acide ethanoique pur (100ml)
Butan-1-ol pur (200ml)
Soude à 2.0mol.l-1
Acide sulfurique à 5mol.l-1.
Erlenmeyer (7.5ml d'acide ethanoique, 12ml de butanol et 2 goûttes d'acide sulfurique)
...
Acide (eethanoique) + alcool (butanol) = ester (ethanoate de butyle) + eau
1.2 3) quel est le type de réaction chimique mis en jeu ?
4) Caractérisée cette réaction.
5) en déduire l'équation bilan du titrage.
6) quel est le type de suivi pour mesurer l'équivalence ?
...
3.1 1) quel est le rôle de l'acide sulfurique ajouté ?
5) lors du titrage pourquoi verser l'eau de rinçage du tune à essai de le bêcher contenant la solution à titrer ?
3.2 1) faire un tableau d'avancement de la réaction desterification.
3.4 1) masse volumique de l'acide = 1.05g.cm-3 et masse volumique de l'alcool = 0.81g cm-3. Calculer les quantités de matières présentes dans les 2ml de solution (voir au dessus : dans l'erlenmeyer ) placé dans les tubes à essai à t=0
2) montrer que le mélange est stoechiometrique
3) en vous aidant du tableau d'avancement, calculez la quantité de matière maximale nmax d'ester que lon pourrait espérer synthétiser si la réaction était totale.
4) en vous aidant de votre graphique, qu'elle est la quantité de matière nf d'ester synthétisé au bout d'un temps infini ? Conclure.
5) calculez le rendement n de la réaction desterification.
Bonsoir,
Pour la première question, je pense que tu avais compris qu'il s'agissait d'une estérification.
1.2 4)5)CH3-COOH + CH3-(CH2)3-OH  CH3-COO-(CH2)3-CH3 + H2O
CH3-COO-(CH2)3-CH3 + H2O
Tu peux consulter ce lien, le mécanisme est très explicite : http://travaux.eleves.ensc-rennes.fr/chimiePasAPas/ester_mecanisme.html.
1.2 6) Pour déterminer l'équivalence du va effectuer un titrage acido-basique avec une solution d'hydroxyde de sodium(soude, NaOH). Voir dessin ci contre :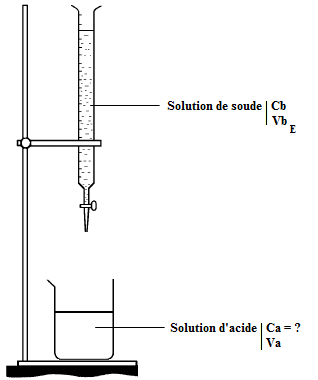
3.1) Pour cette question je te laisse réfléchir à la question... Une aide: Tu vas effectuer un titrage acido-basique, qu'elle est la nature de l'acide sulfurique ?
3.2 1) Calcule les quantités de matières de ton acide et de ton alcool, qu'obtient tu ?
Une fois que tu auras répondu à ces questions, je t'expliquerai les suivantes.
C bon jai fini les 1.2
Je trouve n= 0.02 mol pour les 2 mais initialement au début. J'ai fais la masse volumique par le volume initial divisé par la masse molaire. Pareil pour la 1 du 3.4 mais avec les donnés du texte
Je trouve pour l'acide ethanoique n= 0.03 mol et pour le butanol n= 0.02 mol pour la 3.4 1.
Pour la 3.1 1 je vois vraiment pas. Les autres je les ai faites enfin j'ai essayé. J'ai aussi essayé de faire le tableau d'avancement et tous. ... Pour le graphique je réfléchis aux échelles.
Acide sulfurique est un acide
C'est avec la phénolphtaleine qui est un indicateur coloré que la solution dévient rose et donc acido basique.
Acide c rouge et basique c bleu avec le ph. Donc la c rose donc acide.
Mais appart sa le rôle de l'acide sulfurique jcp.
Le lien ne s'ouvre pas. Et pour les premières questions j'ai mi réaction esterification. Pour la caractérisée j'ai mi Acido basique.
L'équation bilan j'ai mi l'acide et alcool qui dont lester et l'eau.
En règle générale, l'ajout un acide (acide sulfurique ici) permet lors d'une réaction acido basique de donner des protons H+, protons nécessaires pour effectuer un titrage.
Pour la 3.4 . Tu obtient n=0,13 mol pour l'acide et également n=0,13mol pour l'alcool.
La réaction est stchiométrique car pour une mole d'acide et une mole d'alcool il se forme une mole d'ester et une mole d'eau.
Ensuite, on peut dire d'une réaction qu'elle est totale, lorsque tous les réactifs introduits sont épuisés. Ainsi d'après ton tableau d'avancement effectué à la question 3.4 , les deux réactifs sont épuisés en même temps (on pourrait dire de manière général qu'ils sont tous deux réactifs limitants), par conséquent il se forme n=0,13 mole d'ester.
C'est pour demain. Je crois que je me suis trompé au 5 du 1.2 La réaction bilan du titrage c'est l'acide et l'alcool donc lester avec la soude et je vois pas comment faire l'équation bilan. Comment trouvez vous 0.13 mol ? Du coup mon tableau d'avancement est faux. Aidez moi vite s'il vous plaît.
Je comprend pas 4 et 5 du 3.4 Sinon j'ai fais le reste.
n = m / M or m = p * V
donc pour l'acide éthanoique : M = 12*2 + 4 + 2*16 = 60g.mol
donc n =( p * V) / M = n = 1,05 * 7,5 / 60 = 0,13 mol.
pour l'alcool c'est la même procédure :
M=74 g.mol donc n= 0,81 * 12 / 74 = 0,13 mol.
Vous comprenez ?
Au vu de votre énoncé je ne vois pas quel solution est titré, et ce que vous recherchez ..
C BON j'ai compris d'où vient le 12 et 7.5 et pour le tableau d'avancement du coup je remplace juste mes valeurs fausses par les vrai ?
La 4 du 3.4 je ne comprend vraiment pas.
Le réactif titre est acide ethanoique et le réactif titrant est la soude. Je vois pas comment écrire l'équation bilan du titrage.
Il me manque juste l'équation bilan du titrage. Mon tableau à modifié. Le 4 et 5 du 3.4 que je ne comprend vraiment pas
4) en vous aidant du graphique (0.014 mol pour 0 min, 0.0022 pour 7, 0.003 pour 15, 0.004 pour 25, 0.0068 pour 35, 0.0078 pour 50 et 0.0082 pour 60 min), qu'elle est la quantité de matière finale nf d'ester synthétise au bout d'un temps infini. Conclure.
5) calculer le rendement n de la réaction d'esterification.
Pour l'équation de titrage écrivez les deux couples acido-basique mis en jeu...
Vous avez bien étudié les équations acido-basique?
Oui. Justement je ne vois pas comment les écrire. Je sais que c'est la soude na+ et oh- avec ch3cooh mais après jcp. Pouvez vous me donnez les 2 équations svp ?
Et pour les 4 et 5 du 3.4 ?
Ah non ce n'est pas du tout la même chose, une oxydoréduction c'est un échange d'électrons et une réaction acido-basique c'est un échange de proton.
On a OH- +H -> H2O Les ions Na+ sont spectateurs.
Et on a CH3COO- +H+ -> CH3COOH.
Et là vous additionnez les deux demies équations.
Cela donne quoi ?


