Inscription / Connexion Nouveau Sujet
Titrage exercice
Bonsoir j'ai besoin de votre aide pour l'exercice suivant :
On étudie le titrage d'une solution d'acide nitrique (H3O+(aq), NO3-(aq)) de volume VS = 200 ml et de concentration Cs inconnue par une solution d'hydroxyde de sodium (Na+(aq), HO-(aq)) de concentration c = 2,0*10-1mol.L-1.
L'équation de la réaction support de titrage s'écrit : H3O+(aq) + HO-(aq) —> 2 H2O (l).
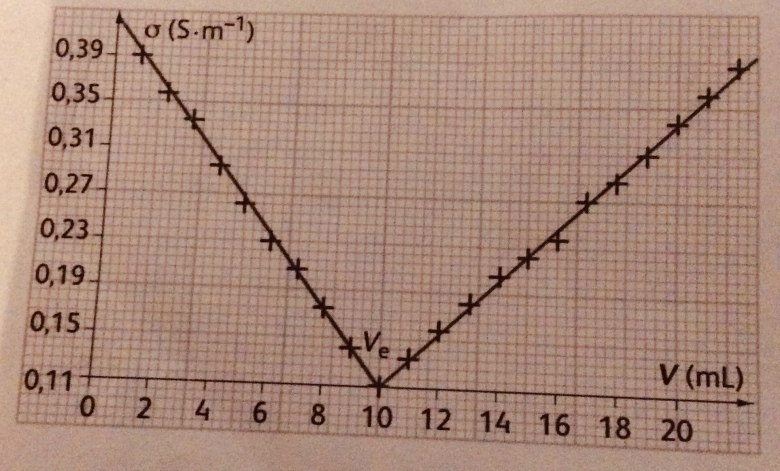
On obtient la courbe que j'ai mis en image, celle-ci représente la conductivité  en fonction du volume V de solution d'hydroxyde de sodium versé . On note les conductivités molaires ioniques suivantes (en mS.m2.mol-1):
en fonction du volume V de solution d'hydroxyde de sodium versé . On note les conductivités molaires ioniques suivantes (en mS.m2.mol-1):  (H3O+)=35;
(H3O+)=35;  (HO-) = 20;
(HO-) = 20;  (Na+) = 5,0 ;
(Na+) = 5,0 ;  (NO3-)=7,1
(NO3-)=7,1
Question:
1) Quels sont les 2 ions réactifs ?
2)a) Quel est le réactif titré ? b) Quel est le réactif titrant ?
3) Quels sont les 2 ions spectateurs?
4) Expliquez l'évolution de la conductivité du mélange réactionnel au cours du titrage. On distinguera 2 phases : avant et après l'équivalence. On discutera de l'évolution de chaque ion.
Réponses:
1) Les 2 réactifs sont l'ion oxomium (H3O+) et l'hydroxyde (HO-)
2) a) Le réactif titré est H3O+, on cherche Cs inconnue
b) Le réactif titrant est HO-, on connaît c = 2,0*10-1mol.L-1
3) Les ions spectateurs sont ceux qui ne figurent pas dans l'équation chimique, donc ce sont NO3 - et Na+.
4) Ici j'ai dû à visualiser l'évolution de la quantité de chaque ion entre l'avant et l'après équivalence, si quelqu'un peut m'expliquer très clairement ceci je le remercie.
Merci
Bonsoir
Ce que tu as fais jusqu'ici est correct.
Pour la suite : quand tu ajoutes un ion Na+ et un ion HO- : quels sont les ions qui apparaissent en solution ? Quel sont ceux qui disparaissent. De la réponse, tu peux déduire si la conductivité augmente ou diminue.
Bonjour merci pour votre réponse, si je comprends bien pour la 4) si on ajoute un ion Na+ et un ion HO- on fait diminuer les ions H3O+ et NO3- avant l'équivalence, par conséquence la conductivité augmente et inversement après l'équivalence la conductivité augmente car les ion Na+ et H0- diminuent et les ions H3O+ et NO3- augmentent ? À-t-on l'influence des ions spectateurs ?
Merci pour votre aide
Non. Avant l'équivalence, quand tu ajoutes un ion Na+ et un ion HO- en solution : l'ion Na+ reste en solution sans réagir alors que l'ion HO- réagit avec un ion H3O+ .
Bilan de cet ajout : apparition d'un ion Na+ et disparition d'un ion H3O+.
Compte tenu des conductivités molaires de ces deux ions, la conductivité de la solution augmente ou diminue lors de cet ajout ?


