Inscription / Connexion Nouveau Sujet
Temps de demi-réaction et courbe
Bonsoir à tous,
D'abord, merci à vous pour l'aide que vous pourrez m'apporter.
Voilà mon soucis:
Je travaille actuellement sur les temps de demi-reaction dans le cadre du chapitre sur la cinétique chimique.
Voici mon exercice:
Le pentaoxyde de diazote N2O5 est un des oxydes d'azote présents dans les gaz d'échappement des voitures.Il subit une réaction de décomposition en phase gazeuse :
N2O5 (g)→ 2 NO2 (g)+12 O2 (g)
Cette réaction est suivie en déterminant la concentration de N2O5 en fonction du temps t.
t (en min). 0 5 10 15 30 45
[N2O5] (en mmol·L−1) 41,2 30,7 22,6 16,7 6,65 2,64
On me demande de tracer [N2O5]=f(t)
C'est donc ce que j'ai réalisé. Cependant, j'obtiens une courbe décroissante et l'asymptote qui doit me permettre de trouver le temps de Demi-reaction est par conséquent beaucoup trop « basse ». De plus, tous les exemples que j'ai trouvé sur internet sont des courbes croissantes. J'ai donc l'impression que j'oublie une étape ou bien que la méthode n'est pas bonne. Je n'ai pas encore fait le cours sur ce chapitre mais aimerais tout de même comprendre ce qui cloche afin de comprendre pourquoi ce que je fais ne fonctionne pas. Il s'agit sûrement de quelque chose de très simple mais que je n'arrive pas à assimiler.
Cordialement,
cdaa
Bonjour,
Il est parfaitement normal que la courbe qui représente l'évolution de concentration d'un réactif soit décroissante.
Peut être pourrais tu poster la courbe que tu obtiens.
Pardon je ne savais pas qu'il fallait prendre les photos à l'envers pour qu'elles soient retournées.
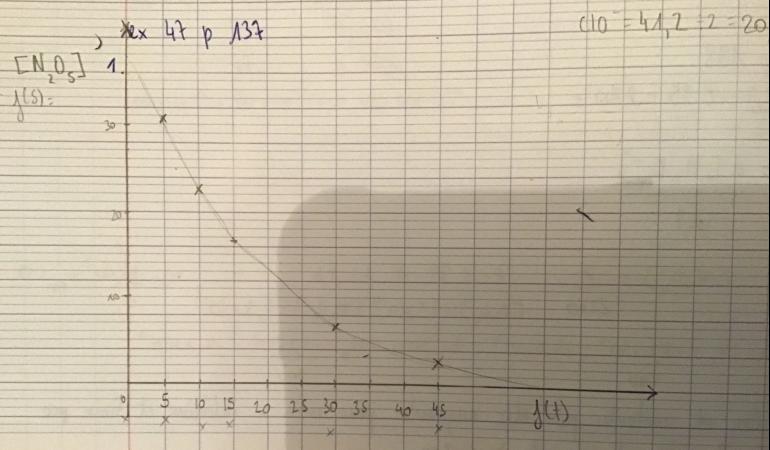
Je pense que j'ai trouvé une façon de faire. Elle consiste à diviser la quantité initiale de réactif par 2 et de reporter la valeur sur ma courbe. J'obtiens 20,6mmol.L-1 qui donne 12,5 min. Soit un temps de Demi-reaction de 12,5min.
En terminale, on définit le temps de demi-réaction comme le temps nécessaire pour que la moitié du réactif limitant soit consommé.
Ta méthode de résolution est correcte.
Toutefois je te conseille de tracer une courbe de grande taille sur un papier adapté (soit millimétré, soit à petits carreaux) pour améliorer la précision de ton résultat.
Msanchezzz, bonjour
cela n'est pas le principe de notre site
de plus, tu postes ici, et simultanément tu ouvres un sujet pour la même demande, ce que nous appelons du multipost et qui est interdit 
Je t'invite à lire : ![]() [***A LIRE AVANT D'AGIR***] Règles du forum
[***A LIRE AVANT D'AGIR***] Règles du forum
et ceci :


 moteur de recherche
moteur de recherche page de choix du forum
page de choix du forum fiches du site
fiches du site
