Inscription / Connexion Nouveau Sujet
Tu prends la dernière valeur c'est tout. Mais ce sera très approximatif (tu aurais dû continuer un peu, ton tracé ne se stabilise pas).
Tu as A = kC donc C = A/k et ensuite avec le volume tu as ta quantité de matière finale.
La dernière valeurs par conséquent celle a 20min?
PS: je n'ai pas eu le temps de terminer mon expérience
Donc je prend le premier coef directeur que j'ai trouver avec mon 1er graphique en tournant la formule A=k*C ==>k=C/A ensuite je prend l'absorbance a 20min dans le deuxième graphique je reprend la formule C=A/k et ensuite j'additionne le volume V1 et V2 pour trouver la quantité de matière finale et ça c'est xf?
J'ai trouver quelque chose de bizar pour la quantité de matière n = 33000 mol ce n'est pas possible c'est trop haut non?
dsl je me suis tromper au lieu de mettre k=C/A j'ai mis k=c*A mais donc pour trouver le coef directeur c'est k=C/A?
A = kC donc k = A/C
Et 33 000 mol c'est totalement déraisonnable
Est-ce-que tu peux arrêter de flooder stp?
Donc je trouve k=343 L.mol
et ensuite avec le coef directeur je trouve C=5,6*10 puissance-3 mol.L
mais pour la quantité de matière je fais n=C*V1+V2 ? et le n que je trouverais c'est xf?
C'est poster plusieurs messages à la suite. Si tu as oublié quelque chose ok, mais lorsque c'est récurrent on fini par ne plus trop s'y retrouver et par avoir des topics de plusieurs pages.
Là c'est dans la bonne fourchette de valeur. Oui c'est bien ça pour xf
Désolé je ne savais pas je vais faire attention.
Donc je trouve xf = 0,28 mol et pour xmax je trouve xmax=1,0*10 puissance-4.
Pour répondre a la question de comparer je peux dire que xmax<xf ?
Ce n'est pas grave et ce n'est pas sanctionné mais ça rend le topic moins lisible 
J'ai oublié de corriger une erreur : pourquoi V1 + V2?
Parce que vous m'aviez dis qu'il fallait que j'additionne les deux car ce sont les 2 réactif qui réagissent ensemble non?
Non après relecture du topic je n'ai pas dit ça 
Les ions iodure ne sont apportés que par la solution 1 donc ne considère que V1
ça dois etre moi qui me suis tromper certainement donc avec seulement V1 je trouve n= 0,56mol c'est ça?
Non tu dois trouver 5,6.10-5 mol
En effet xf = C*V1 = 5,6.10-3*10.10-3 =5,6.10-3*1,0.10-2 = 5,6.10-3+(-2) = 5,6.10-5 mol
Et là xf
TU trouverais peut être une valeur plus proche de xmax en prolongeant l'expérience 
N'oublie pas que dans n = C*V tu as n en mol, C en mol/L et V en L. Or 10 mL = 10.10-3 L = 1,0.10-2 L
Ok?
oui c'est bien ça mais ajoute que tu aurais cependant dû poursuivre un petit peu la réaction afin de constater un rapprochement entre xf et xmax
D'accord, maintenant comment je fais pour déterminer la vitesse v en fonction de [I2] puis en fonction de A?
A = k*[I2]. Dans ton cours tu dois avoir la formule générale de la vitesse. Il te suffit de remplacer tout simplement dans l'expression du cours
Pour l'instant a cette question je dois juste faire un calcule littérale, juste déterminer l'expression
J'avais compris...
Forme générale de la vitesse 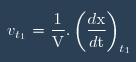
Courbe théorique : 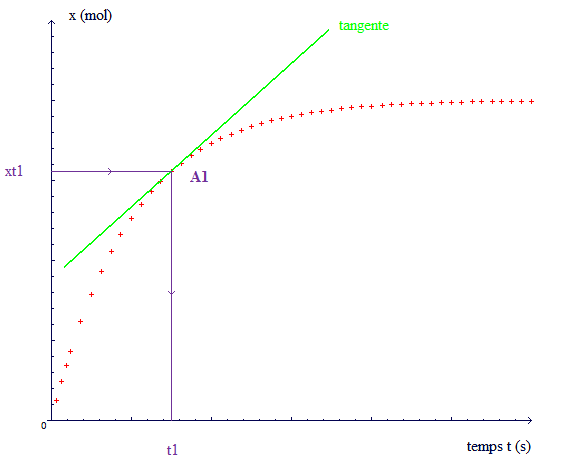
Formule pour calculer la vitesse en un point : 
Prend surtout la dernière formule.
Tu fais simplement v = (1/V)*k
Or tu connais k en fonction de C et A
on a pas besoin de faire une expression en fonction la concentration et une autre expression en fonction A ? on réunie directement?
donc je dis que:
on a v = 1/V*dx/dt avec a=k*c or k= A/C
donc v = (1/V)*k devient v= (1/V)*A/C
je peux marquer ceci sur mon exercice?
Si les tangentes ont tendance à devenir de plus en plus horizontales alors ça veut dire que ta vitesse diminue. C'est tout
est-ce que je peux utiliser la formule trouve ci dessus pour déterminer la vitesse ou ce n'est pas nécessaire parce qu'il demande dans l'énoncé d'utiliser la question précédente pour déterminer comment évolue la vitesse?
Tu vois que l'absorbance augmente, or elle est au numérateur. V reste constant et C est proportionnel à A...
Donc qualitativement ce n'est pas super pour deviner
L'avancement volumique x/V est, à chaque instant égal à la concentration molaire [I2]formé.
Le tableau d'avancement te montre qu'à tout instant l'avancement x de la réaction est égal à la quantité de molécules de diiode formé : x = n(I2)
Par conséquent, l'avancement volumique x/V de la réaction est x/V = n(I2)/V
Soit : x/V = [I2]
Donc ce terme est constant.
Tu en déduis que la vitesse diminue
Voici une correction du tableau d'avancement : 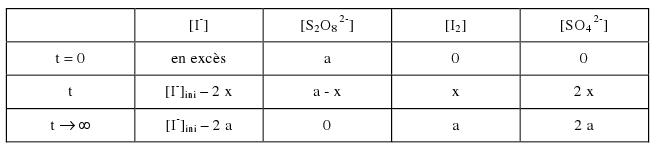
Voici la courbe que tu devrais obtenir (je ne t'en donne pas l'équation je n'ai pas déterminé ça comme toi): 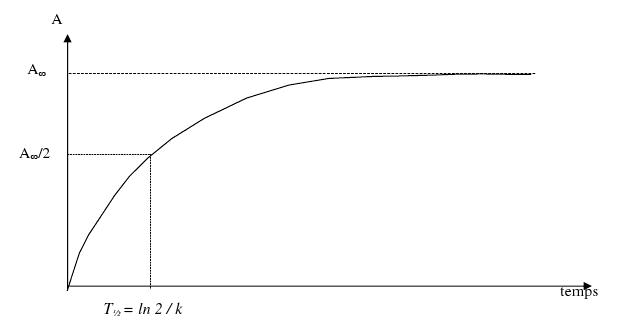
Et ce que je trouve à partir du tableau et des relations que nous avons trouvées ensemble : 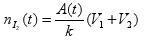
ah d'accord donc je peux mettre ce que vous avez mis pour répondre a la question? (moi je pensais plus compliquer)
le tableau d'avancement c'était pour les premières questions (j'avais oublié de le joindre)
Le graphique tu le mets dans la dernière question, à moins que tu n'aies tracé le tien. mais en gros c'est ce que tu aurais dû obtenir si tu avais achevé l'expérience



