Inscription / Connexion Nouveau Sujet
Schéma de Lewis
Bonjour, j'aimerai écrire le schéma de Lewis de C6H706-.
Pour cela j'ai déterminer les couches électroniques de chaque atomes.
C, Z=6 donc on a 1s22s22p2
H, Z=1 donc on a 1s1
O, Z= 8+1 donc on a 1s22s22p5
Maintenant je sais qu'il faut déterminer le nombre d'électrons de valence mais c'est ça que je ne comprends pas.
Bonjour,
Les fiches de l'île sont tes amies : ![]() De la structure à l'électronégativité des entités et à la polarité des molécules
De la structure à l'électronégativité des entités et à la polarité des molécules

ok donc si j'ai compris il y a 4 électrons de valence pour C
1 pour H
7 pour O
donc au total 4x6+7x1+7x6 ???
Déroule la méthodologie jusqu'à son terme et ne t'arrête pas en chemin 
Je te conseille dans un premier temps de t'intéresser à la structure de Lewis de l'acide ascorbique puis d'identifier les quatre protons susceptibles d'être "arrachés" par une base.

Bonjour vanoise,
La coquille vient du fait qu'il y a eu (je pense) une tentative de considérer l'ion ascorbate en rajoutant un électron :
O, Z= 8+1 donc on a 1s22s22p5
Raison pour laquelle j'ai conseillé de revenir dans un premier temps à l'acide ascorbique ...

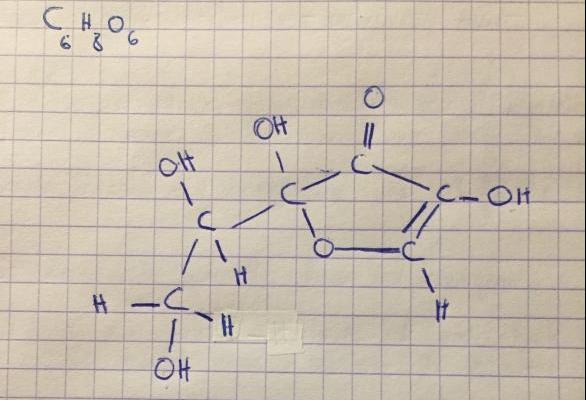
Donc je considère maintenant l'acide ascorbique: C6H8O6
Donc j'écris d'abord la configuration électronique de chaque atome :
*C: 1s22s22p2. Donc 4e- de valence.
*H: 1s1. Donc 1e- de valence.
*O: 1s22s22p4. Donc 6e- de valence.
C'est une molécule donc z=0
On a donc x= (6*4+8*1+6*6)-0=68e-.
L'entité peut donc former nt= =34 doublets au total.
Je n'ai pas compris ce que signifié les doublets, c'est à dire qu'il faut dessiner "34 barres" au total ?
Bonjour,
Donc je considère maintenant l'acide ascorbique: C6H8O6
Donc j'écris d'abord la configuration électronique de chaque atome :
*C: 1s22s22p2. Donc 4e- de valence. ok
*H: 1s1. Donc 1e- de valence. ok
*O: 1s22s22p4. Donc 6e- de valence. ok
C'est une molécule donc z=0 ok
On a donc x= (6*4+8*1+6*6)-0=68e-. ok
L'entité peut donc former nt=
Je n'ai pas compris ce que signifié les doublets, c'est à dire qu'il faut dessiner "34 barres" au total ?
Il faut que tu révises avec la fiche les notions de doublet liant et doublet non liant :
* 1 doublet liant compte pour 1 électron puisque l'autre électron viendra de sa mise en commun avec un autre atome pour respecter la règle du duet et de l'octet.
Par exemple, l'oxygène aura donc 2 doublets non liant (attention tu as oublié de les représenter) et 2 doublets liants : 2*2 + 2 = 6 électrons de valence.
A partir de la structure de Lewis de l'acide ascorbique, quels sont les quatre protons susceptibles d'être "arrachés" par une base ?

Oui ! Il suffit désormais d'identifier les quatre protons susceptibles d'être "arrachés" par une base.

Quelle est la définition d'une réaction acide/base ?
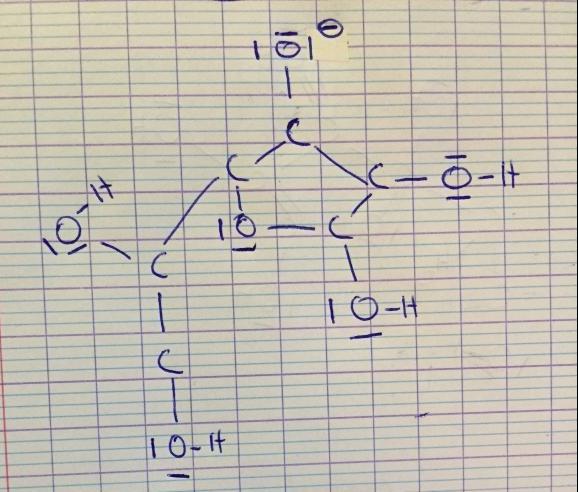
Par "Il suffit désormais d'identifier les quatre protons susceptibles d'être "arrachés" par une base" je voulais écrire qu'il y a 4 possibilités d'écrire la formule de Lewis pour l'ion ascorbate ...
Selon Brönsted une réaction acido-basique correspond au transfert d'un proton H+ de l'acide du couple vers la base d'un autre couple.
Donc c'est à dire qu'il faut que je choisisse 1 proton de l'acide ascorbique (parmi les 4 ?) pour le "transférer" dans dans l'ascorbate ?
Selon Brönsted une réaction acido-basique correspond au transfert d'un proton H+ de l'acide du couple vers la base d'un autre couple.
Oui !
Donc c'est à dire qu'il faut que je choisisse 1 proton de l'acide ascorbique (parmi les 4 ?) pour le "transférer" dans dans l'ascorbate ?
Cela signifie que l'acide ascorbique va céder un proton H+ pour devenir l'ion ascorbate.
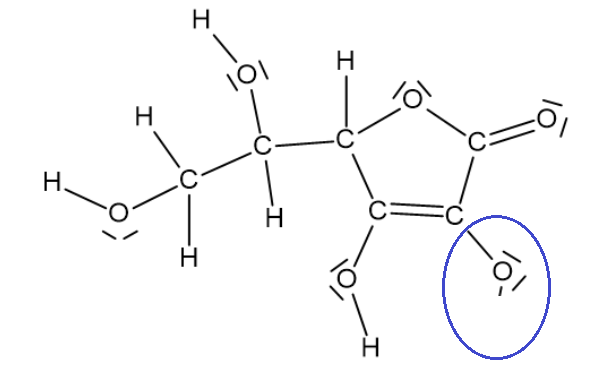
Concernant ta proposition de schéma, tu as en effet 4 groupes -OH, l'un d'eux va donc perdre un proton H+ tel que tu as proposé. En revanche, pourquoi avoir rajouté un doublet non liant à ton oxygène ?

C'est faux ? j'ai voulus représenter 7e- de valence...
Je me suis dit que c'était le même cas que l'ion carboxylate...
J'ai pas bien compris le 6) de la méthode du schéma de Lewis. Donc pour chaque atome je dois calculer leurs charges formelles .
A chacun je dois déterminer Cf=nv -
Pour O, cf=6-6=0
Pour H, cf=1-1=0
Pour C, cf= 4-4=0
Est-ce normal de trouver zero à chaque fois ?
Cela siginifirai qu'il n'y a pas besoins de mettre +ou - , comme je l'ai dit au dessus ...
Bonjour,
Mais c'est quoi la petite barre à côté de O dans la partie que vous avez entouré ? Le signe - ?
Oui !
J'ai pas bien compris le 6) de la méthode du schéma de Lewis. Donc pour chaque atome je dois calculer leurs charges formelles .
A chacun je dois déterminer Cf=nv -
Pour O, cf=6-6=0
Pour H, cf=1-1=0
Pour C, cf= 4-4=0
Est-ce normal de trouver zero à chaque fois ?
Cela siginifirai qu'il n'y a pas besoins de mettre +ou - , comme je l'ai dit au dessus ...
Je regarderai ça plus tard, je ne vais pas être trop dispo aujourd'hui (préparatifs de départ ...)