Inscription / Connexion Nouveau Sujet
relation gaz temperature volume et pression
Bonjour, Encore moi, il y avait une question avec les gaz volume pression température qui m'a ennervé. Dans un premier temps je m'attendais à la loi des gaz parfais mais les conditions ne sont TPN .
Franchementj'ai trouvé la réponse par déduction et de manière incertaine. Comme d'habitude ^^
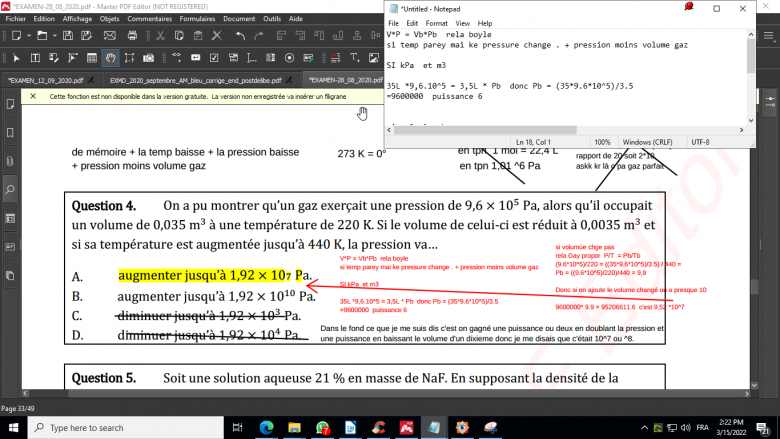
"On a pu montrer qu'un gaz exerçait une pression de 9,6 × 105 Pa, alors qu'il occupait
un volume de 0,035 m3 à une température de 220 K. Si le volume de celui-ci est réduit à 0,0035 m3 et
si sa température est augmentée jusqu'à 440 K, la pression va…
A. augmenter jusqu'à 1,92 × 107 Pa.
B. augmenter jusqu'à 1,92 × 1010 Pa.
C. diminuer jusqu'à 1,92 × 103 Pa.
D. diminuer jusqu'à 1,92 × 104 Pa
"
Je me suis dit :
Va*Pa = Vb*Pb rela boyle si temperature est la meme mais que la pression change .
On sait que :
+ pression moins volume gaz
SI kPa et m3
35L *9,6.10^5 = 3,5L * Pb donc Pb = (35*9.6*10^5)/3.5
=9600000 puissance 6
si volume change pas pour la temparature par rapport à la pression
rela Gay proportionnel P/T = Pb/Tb
(9.6*10^5)/220 = ((35*9.6*10^5)/3.5) / 440 =
Pb = ((9.6*10^5)/220)/440 = 9,9
Donc si on ajoute le volume changé on a presque 10
9600000(rela boyle)* 9.9(rela gay) = 95206611.6 c'est 9,52 *10^7
Dans le fond ce que je me suis dis :
on a gagné une puissance ou deux en doublant la pression et une puissance en baissant le volume d'un dixieme
donc je me disais que c'était 10^7 ou ^8.
Merci
Bonjour
Loi des gaz parfaits : n*R = pV / T
n*R est constant donc
p1V1 / T1 = p2 V2 / T2
p1V1T2 = p2V2T1
p2 = p1V1T2 / V2T1
L'énoncé indique que T2 = 2T1 et que V2 = V1 / 10
p2 = p1 * V1 * 2T1 / (V1/10) * T1
Après simplification : p2 = 20 p1
p2 = 20 * 9,6.105 = 1,92.107 Pa
ah oui merci !
Donc tu n'utilises meme pas vraiment la relation de boyle.
Mais on peut utiliser la loi des gaz parfais alors que l'on est pas dans des condition température et pression normales ?
Comment sais tu que n*R est constant? C'est vrai qu'ils ne précisent les mol dans l'énnoncé ni sa variation.
Enfin encore merci en tout cas 
Donc tu n'utilises meme pas vraiment la relation de boyle.
La loi de Boyle Mariotte peut être considérée comme un cas particulier de la loi des gaz parfaits.
Il en est de même des lois de Gay-Lussac et de Charles.
Mais on peut utiliser la loi des gaz parfais alors que l'on est pas dans des condition température et pression normales ?
La loi des gaz parfaits est une loi approchée qui peut être appliquée avec une bonne précision tant que la pression reste inférieure à 10 bars environ ( Voir ici --->)
Comment sais tu que n*R est constant? C'est vrai qu'ils ne précisent les mol dans l'énnoncé ni sa variation.
L'énoncé évoque un gaz dont on modifie le volume et la température et rien n'indique que la quantité de matière gazeuse soit modifiée : n est donc constant
R est une constante donc le produit nR est également constant.


