Inscription / Connexion Nouveau Sujet
Préparation d'une solution d'acide chlorhydrique
Bonjour j'ai besoin de votre aide svp , je bloque à la question 2)
Exercice :
On dissout un volume V=336 ml de chlorure d'hydrogène , pris à la la pression de 1 bar et à la température de 25°C , dans V=50 ml d'eau pure . On assimile le gaz à un gaz parfait . La dissolution n'entraîne pas de changement de volume.
1- Écrire l'équation bilan de la réaction de dissolution
2- Déterminer la quantité de matière de HCl dissoute.
3-En déduire le pH de la solution.
Réponses:
1- HCl + H2O  H3O+ + Cl-
H3O+ + Cl-
2-
Mais là ,on a pas le volume molaire donc je ne sais plus quoi faire
Bonjour,
1. OK
2. On te précise justement qu'on assimile HCl à un gaz parfait, il faut donc appliquer la loi des gaz parfaits : P.V = n.R.T
soit n = ?
3. Calcule la concentration molaire de cette solution.
Lis ceci : ![]() PH acide
PH acide

P = pression en Pa
R constante des gaz parfaits = 8,314 SI
T = température en K
V volume en m3
n quantité de matière en mol
Attention donc aux conversions d'unité
Oui mais on a les autres données fournies :
P * V = n * R * T
soit n = (P * V) / (R * T)
P = 1 bar = ... Pa
R = 8,314 SI
T = 25°C = ... K
V = 336 mL = ... m3
Oui mais là , on a pas la quantité de matière puisque c'est elle qu'on cherche
Oui mais on a les autres données fournies :
P * V = n * R * T
soit n = (P * V) / (R * T)
P = 1 bar = 100.000 Pa
R = 8,314 SI
T = 25°C = 298,15 K
V = 336 mL = 3,36.10-4 m3

n=(P*V)/(R*T)
n=(105*3,36.10-4)/(8,314*298,15)
n=0,0135 mol
Je croyais que V étais le volume molaire
Par définition Vm = V / n
donc si on reprend la loi des gaz parfaits :
P * V = n * R * T
<=> V / n = R * T / P
<=> Vm = R * T / P
OK avec ton calcul sinon 
D'accord avec cette relation , VM est en litre mol ?
3-Calcul de la concentration molaire C de la solution
C=n(HCl)/V
C=0,0135/0,050
C=0,27 mol/L
Là , on doit tenir compte de la concentration des ions hydronium apportée par l'autoprotolyse de l'eau non?
C'est parce que C 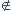 [10-6 ; 10-2]
[10-6 ; 10-2]
[H3O+]=0,27+10-7=0,2700001
pH=-log[H3O+]=0,57
Ça n'a pas changé grand chose!
Houlà tu es sûr de ton coup ?
Cela me paraît très faible comme valeur de pH

Eh bien , c'est ce que j'ai trouvé , il y aurais une erreur quelque part ?
J'ai vérifié tes calculs, attention aux arrondis :
n(HCl) = 1,36.10-2 mol
Dans une telle solution, on a : [H3O+]totale = [H3O+]ac chlor + [H3O+]autoprotolyse
[H3O+]ac chlor = 0,27 mol.L-1 (ok avec ton calcul)
[H3O+]autoprotolyse = 10-7 mol.L-1
Donc effectivement, l'autoprotolyse de l'eau est négligeable dans cette situation
et pH = -log(0,27) = 0,57.
En même temps, je n'avais pas fait attention en première lecture, on a une solution concentrée.



