Inscription / Connexion Nouveau Sujet
précipités
Bonsoir, j'ai beaucoup réfléchi sur cet exo mais en vain. Le voici:
Guy dispose d'une solution S1 de chlorure de cuivre II, d'une solution S2 de chlorure de zinc et d'une solution S3 de chlorure de fer III, toutes les trois de concentration c0 =3,00.10-2 mol/L. Il dispose également d'une solution S d'hydroxyde de sodium de concentration c=1,00mol/L.
Il mélange un volume V'=100mL de chacune des solutions S1, S2, S3. Il obtient ainsi une solution S0 de volume V0. A l'aide d'une micropipette, il y ajoute très progressivement de petits volume de solution S. Il appelle V le volume de solution S ajouté. Ce volume étant faible (quelques dizaines de millilitres) par rapport à V0, on considérera que le volume total reste constant au cours de cette opération.
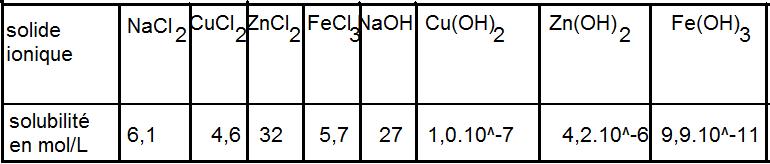
On donne ci-dessous les solubilités des différents solides possibles.
1)Déterminer les concentrations effectives de tous les ions présents dans la solution S0 avant tout ajout de solution S.
2)Expliquer ce qu'il se passe lorsqu'on ajoute très progressivement la solution S à la solution S0.
3)Déterminer le précipité qui apparait en premier et le volume V de solution S ajoutée pour lequel il apparait.
4)On considère qu'au départ, l'ajout de S ne fait précipiter qu'un seul composé. Il faut attendre que tout ce composé ait précipité pour qu'un autre précipité apparaisse. Déterminer pour quelles valeurs de V on observe la précipitatuon des hydroxydes de fer, cuivre et zinc.
5)Verra-t-on la précipitation du chlorure de sodium?
____
1)Ok.
2)Moi je dirais que les ions Cu2+, les ions Zn2+, les ions Fe3+ vont réagir avec l'ion OH- de l'hydroxyde de sodium pour former differents précipités.. mais pourquoi pas l'ion Cl-? Je pense que le "très progressivement" a son importance..
3)Pour savoir quel précipité sera formé en premier, il faut surement regarder les solubilités données mais je ne vois pas quel lien faire.
Pour trouver le volume V il faut probablement diviser une quantité de matière, mais laquelle et comment le savoir? par une solubilité en mol/L non?
4)même question que pour la 3)
5)d'où vient ce chlorure de sodium?
merci de me donner des pistes
2) oui
Cu 2+ + 2HO- --> Cu(OH)2 hydroxyde de cuivre
Zn 2+ +2 HO- --> Zn(OH)2 hydroxyde de zinc
Fe 3+ +3 HO- --> Fe(OH)3 hydroxyde de fer
mais les ions Cl- et les ions HO- sont compatibles , ils ne réagissent pas entre eux , lorsqu'ils sont en solution ils " s'ignorent " entre eux. On les dit qu'ils sont compatibles.
3) oui tu as raison pour savoir quel précipité sera formé en premier, il faut surement regarder les solubilités données .
plus que la solubilité est est faible plus que le composé ionique précipite rapidement.
mais les ions Cl- et les ions HO- ne réagissent pas entre eux , lorsqu'ils sont en solution .
ils "s'ignorent"car ils sont compatiblent , si tu veux ils se comportent comme des amis , ils n'entreront pas en réaction entre eux.
c'est compris maintenant?
Cu 2+ + 2HO- --> Cu(OH)2 hydroxyde de cuivre s=10-7
Zn 2+ +2 HO- --> Zn(OH)2 hydroxyde de zinc s=4,2.10-6
Fe 3+ +3 HO- --> Fe(OH)3 hydroxyde de fer s=9,9.10-11
donc c'est Fe(OH)3 qui est le moins soluble et par conséquence il se précipite le 1er.
or n(Fe3+)=C0.V'=3,00.10 -2 mol/L.0,1L=3.10-2 mol
et d'après l'équation
Fe 3+ +3 HO- --> Fe(OH)3
n(Fe3+)=n(HO-)/3
tu peux maintenant savoir le volume de soude qu'on doit ajouter.
n(Fe3+)=n(HO-)/3
=>n(HO-)=3n(Fe3+)=3.10-2 mol
Fe 3+ +3 HO- --> Fe(OH)3
n(Fe3+)=n(HO-)/3 => n(HO-)=9.10-2mol/L
[Fe3+]=[HO-]/3 = s =4,2.10-6mol/L
[HO-]=12,6.10-6 mol/L
d'autre part: soit v le volumede sode ajouté.
[HO-]=n/(3V+v)
et tu tire v.
bonsoir,
subsiste une incompréhension :
n(Fe3+)= c0V'=1,00.10^-1 X 3,00.10^-2 = 3,00.10^-3 non?
et dans ta dernière égalité, qu'est ce que n?
oui
n(Fe3+)=C0.V'=3,00.10 -2 mol/L.0,1L=3.10-3 mol
donc:
Fe 3+ +3 HO- --> Fe(OH)3
n(Fe3+)=n(HO-)/3 => n(HO-)=9.10-3 mol/L
[Fe3+]=[HO-]/3 = s =4,2.10-6 mol/L
[HO-]=12,6.10-6 mol/L
je trouve [Fe3+]=c0/3=1,00.10^-2 mol/L
d'où vient ton 4,2.10^-6 mol/L?
...
PS: peux s'il te plait expliquer le but de tes calculs?
merci
s =4,2.10-6 mol/L solubilité de Fe(OH)3
d'après le tableau de solubilité
c'est le nombre de mole maximal qu'on peut dissoudre par litre de solution , c'est ce qu'on doit faire précipiter .
si tu regardes bien le tableau la solubilité de Fe(OH)3 est de 9,9.10-11 mol/L
pourrais tu m'expliquer la démarche à suivre pour déterminer V plutôt que d'écrire des calculs dont je ne comprends pas le sens?  Ca serait plus simple pour moi, merci
Ca serait plus simple pour moi, merci
Fe 3+ +3 HO- --> Fe(OH)3 hydroxyde de fer s=9,9.10-11
oui oui c'est la valeur qu'on devrait prendre.
...
donc tu proposes de faire
[HO-]=(1,00.V)/((3,00.10^-1)+V)?
que ça soit clair 
mais on a deux inconnues : V et [HO-] non?
Fe 3+ +3 HO- --> Fe(OH)3
[Fe3+]=[HO-]/3 =s= 9,9.10-11 mol/L
[HO-]=29,9.10-11 mol/L
tu aura 1 seul inconnu.V
3)Déterminer le précipité qui apparait en premier et le volume V de solution S ajoutée pour lequel il apparait.
le précipité qui apparait en premier est le moins soluble.on compart les solubilités pour savoir celui qui va précipiter en premier .
mais la solution n'est saturée donc on ne peut pas écrire
[Fe3+]=[HO-]/3 =s= 9,9.10-11 mol/L
mais on connait n(HO-) introduit dans le mélange lorsque Fe(OH)3 précipite complétet.
car (Fe3+)=C0.V'=3,00.10 -2 mol/L.0,1L=3.10-3 mol
Fe 3+ +3 HO- --> Fe(OH)3
n(Fe3+)=n(HO-)/3 => n(HO-)=3n(Fe3+)=9.10-3 mol/L
par suite [HO-]=9.10-3/V
et [HO-]=(1,00.V)/((3,00.10^-1)+V)
tu as donc 1 seul inconnu. V
par suite [HO-]=9.10-3/V
dans cette expression V est l'inconnu c'est ça?
mais la solution n'est saturée donc on ne peut pas écrire
[Fe3+]=[HO-]/3 =s= 9,9.10-11 mol/L
tu l'as écrit plusieurs fois...
merci je comprends mieux lorsque c'est rédigé

9,00.10^-3/V = 1,00V/((3,00.10^-3)+V)
9,00.10^-3(3,00.10^-3+V)=V².1,00
27,0/10^-3+V9,00.10^-3=V².1,00
c'est bizarre non?
 ok mais c'est pas ce qui m'interesse le plus
ok mais c'est pas ce qui m'interesse le plus
et:
[OH-]=3.1,00.V/((3,00.10^-3)+V)non?
car Fe^3+ + 3OH^- --> Fe(HO)3
qu'en penses tu?
non revient à l'énoncé:
Il mélange un volume V'=100mL de chacune des 3 solutions S1, S2, S3. Il obtient ainsi une solution S0 de volume V0. A l'aide d'une micropipette, il y ajoute très progressivement de petits volume de solution S. Il appelle V le volume de solution S ajouté. Ce volume étant faible (quelques dizaines de millilitres) par rapport à V0, on considérera que le volume total reste constant au cours de cette opération.
S solution d'hydroxyde de sodium de concentration c=1,00mol/L.
salut shadowmiko salut-Romane-
j'envois ma méthode pour pouvoir comparer nos résultats.
27.10-3+V .9,.10-3=V²
il s'agit d'une équation de 2ème degré sous la forme :
a.V2+b.V+c=0
 =b2-4ac
=b2-4ac
V²- (9,.10-3 ).V-(27.10-3) =0
 =(9,.10-3)2+4.(27.10-3)
=(9,.10-3)2+4.(27.10-3) 0,108
0,108


 0,329
0,329
<0 à rejeter.
.
bonjour ,
ce problème m'intrigue car je l'aurais résolu en utilisant les produits de solubilité.
Or ,en 1S,cette notion n'est pas étudiée.
Par contre ,elle l'est dans d'autres sections (STL par exemple).
Romane es tu en 1S?
--------------------------
Guy dispose d'une solution S1 de chlorure de cuivre II, d'une solution S2 de chlorure de zinc et d'une solution S3 de chlorure de fer III, toutes les trois de concentration c0 =3,00.10-2 mol/L. Il dispose également d'une solution S d'hydroxyde de sodium de concentration c=1,00mol/L.
Il mélange un volume V'=100 mL de chacune des solutions S1, S2, S3. Il obtient ainsi une solution S0 de volume V0. A l'aide d'une micropipette, il y ajoute très progressivement de petits volume de solution S. Il appelle V le volume de solution S ajouté. Ce volume étant faible (quelques dizaines de millilitres) par rapport à V0, on considérera que le volume total reste constant au cours de cette opération.
On donne ci-dessous les solubilités des différents solides possibles.
1)Déterminer les concentrations effectives de tous les ions présents dans la solution S0 avant tout ajout de solution S.
---------------------
On a mélangé 100 mL de trois solution dont la concentration en soluté apporté est identique et égale à 3*10^(-2) mol/L. Le facteur de dilution de chacune des solution étant de 3 la concentration en soluté apporté de la solution S0 après mélange vaut donc 10^(-2) mol/L pour chacune des solutés et ces solutés étant totalement dissociés
[Zn^(2+)]=[Cu^(2+)]= [Fe^(3+)]=10^(-2) mol/L
[Cl^(-)]=2*10^(-2)+2*10^(-2)+3*10^(-2)=7*10^(-2) mol/L
---------------------
2)Expliquer ce qu'il se passe lorsqu'on ajoute très progressivement la solution S à la solution S0.
----------------------
Les ions métalliques précipitent successivement car leur produits de solubilité sont différents.
----------------------
3)Déterminer le précipité qui apparaît en premier
----------------------
Je pense qu'il faut répondre La solubilité de Fe(OH)3 étant inférieure à celle de Cu(OH)2 et celle de Zn(OH)2 C'est l'ion Fe^(3+) qui précipitera en premier suivi de l'ion l'ion Cu^(2+) et enfin l'ion Zn^(2+), mais on peut aussi répondre que dans les conditions de pH de la solution S0 la solubilité de Fe(OH)3 de Cu(OH)2 et de Zn(OH)2 sont au moins égales à 10^(-2) mol/L puisque la solution contient les ions Fe^(3+), Cu^(2+) et Zn^(2+) a cette concentration et que l'on ne voit pas bien à quoi correspondent les solubilités des hydroxydes exprimées dans le tableau....
et le volume V de solution S ajoutée pour lequel il apparaît.
----------------------
Je dirais “un certain volume” car on ne connaît pas l'acidité de la solution S0 qui si j'en crois les données de la littérature le pH de cette solution est forcément inférieur à 1.8 et le volume V de solution S ajoutée pour lequel il apparaît dépend de son pH initial sur lequel on ne sait rien.... Maintenant si l'on considère que le pH de la solution S0 est celui de début de précipitation d'une solution de concentration [Fe^(3+)]=10^(-2) mol/L alors cet hydroxyde précipitera à la première goutte de soude ajoutée
----------------------
4)On considère qu'au départ, l'ajout de S ne fait précipiter qu'un seul composé. Il faut attendre que tout ce composé ait précipité pour qu'un autre précipité apparaisse. Déterminer pour quelles valeurs de V on observe la précipitation des hydroxydes de fer, cuivre et zinc.
----------------------
Il est dit dans l'énoncé que “ l'on considérera que le volume total reste constant au cours de cette opération”. Donc on néglige les variations de concentration liées au variations de de volume provoquées par les ajouts de soude.
Si V est le volume de soude nécessaire pour amener le pH de la solution au pH de début de précipitation de Fe(OH)3 qui est 1,804 pour une concentration initiale de l'ion Fe^(3+) de 10(-2) mol/L, la quantité d'ion Fe^(3+) à précipiter est égale à n(Fe^(3+))=C*V=0,3*10^(-2)=3*10^(-2) mol. La réaction de précipitation ayant lieu selon la réaction
Fe^(3+)+3*(OH)^(-)--> Fe(OH)3(s)
que l'on peut considérer comme totale il faudra 3*3*10^(-2)=9*10^(-3) mol d'ion OH^(-) (quantité correspondant à la stoechiométrie de la réaction) pour précipiter les ions Fe(3+) soit 9 mL de solution de soude à 1 mol/L
--------------------
Par un raisonnement semblable on montrerait qu'il faut un volume volume V1 de soude nécessaire pour amener le pH de la solution au pH de début de précipitation de Cu(OH)2 qui est 4,80 pour une concentration initiale de l'ion Cu^(2+) de 10(-2) mol/L et 6 mL de solution de soude à 1 mol/L pour précipiter la quasi totalité des ions
Cu^(2+).
Enfin, après avoir amené le pH de la solution au pH de début de précipitation de Zn(OH)2 qui est 7,23 pour une concentration initiale de l'ion Zn^(2+) de 10(-2) mol/L par l'adition d'un volume de soude V3 il faudra encore 6 mL de solution de soude à 1 mol/L pour précipiter la quasi totalité des ions
Zn^(2+).
Finalement si l'on excepte (ou l'on néglige) les volumes de soude nécessaires pour amener le pH de la solution S0 au pH de début de préciptation des ions Fe^(3+) puis ensuite au pH de début de préciptation des ions Fe^(3+) Cu^(2+) et enfin au pH de début de préciptation des ions Fe^(3+) Zn^(2+) il faudra 21 mL de soude pour précipter quantivement les trois ions de la solution S0.
----------------------
5) Verra-t-on la précipitation du chlorure de sodium?
----------------------
Dans ce cas la concentration de l'ion Na^(+) sera égale à celle de l'ion Cl^(-) et vaudra [Na^(+)]=[Cl^(-)]=7*10^(-2) mol/L valeur très inférieure à celle de la solubilité du NaCl qui vaut 6,1 mol/L et le chlorure de sodium ne précipitera pas.
----------------------
merci à toi Barbidoux mais tes réponses ne semblent pas adaptées.... tu parles de "produits de solubilité" mais je ne l'ai pas appris et nous n'avons pas du tout parlé de pH (ni dans l'énoncé..)
de plus pour la 1) je trouve que la concentration effective en ions Cu2+ est de 1,00.10^-2 mol/L et toi 10.10^-2 mol/L...
pour la 1) je trouve que la concentration effective en ions Cu2+ est de 1,00.10^-2 mol/L et toi 10.10^-2 mol/L
-----------
et mon calcul donne 10^(-2), je ne vois pas la différence car 10^(-2) ou 1,00*10^(-2) c'est la même chose.....
-----------
Quant à l'adaptation des réponse, tu n'est pas responsable du sujet posé mais il faut que tu comprennes que la solubilité est la quantité maximale d'un produit que l'on peut dissoudre dans une solution. Si l'on peut, pour un composé dont les ions ne réagissent pas avec ceux de l'eau, le NaCl par exemple parler sans plus de précision de la solubilité du NaCl dans l'eau, ce n'est pas possible pour un composé qui a des ions communs avec ceux de l'eau (les ion OH^(-) ou H^(+)) dans ce cas là la solubilité du composé va dépendre de la concentration de ces ions dans l'eau. Par exemple si tu prend de l'eau pure (pH=7) qui contient donc une concentration en ion H^(+) égale à 10^(-7) mol tu ne pourra dissoudre que 10^(-17,6) mol/L de Fe(OH)3 par litre d'eau ce qui est extrêmement faible, alors que si tu prends une solution d'acide chlorhydrique de concentration 0,1 mol/L tu peux dissoudre 2,5 mol/L de ce même composé.
Ce qui veut dire que la solubilité de Fe(OH)3 dans ta solution S0 est au moins de 10^(-2) mol/L ce qui est très loin de ce qui est indiqué dans ton tableau.
Tu vois la solubilité de ce composés dépend donc de la composition de la solution d'où mes remarques et les précautions que j'ai prises dans la réponse que je t'ai faite que tu as du mal à comprendre mais qui est le plus simple de ce que l'on peut répondre si l'on veut respecter un minimum de rigueur scientifique et tout cela n'est pas de ta faute... le sujet est difficile et tu n'y est pour rien, mais je en vois pas comment on peu le résoudre correctement autrement.
...pour en revenir au message de 11:55 de 122155, cette équation est elle juste? Est ce juste de dire que la concentration effective des ions OH- dans la solution S est égale à la concentration de ces mêmes iosn dans la solution s0?
merci bien
je propose pour déterminer V au 3)
n(Fe3+)=9,9.10^-11 X 0,3 = cV/3
donc V=2n(Fe3+)/c
est ce possible?




