Inscription / Connexion Nouveau Sujet
précipitation exercice type BAC
Bonjour,
j'ai quelques difficultés à résoudre un exercice. Pourriez-vous m'aider ?
Voici l'énoncé:
On étudie l'equlibre chimique de précipitation et de dissolution du fluorure de magnésium.
1. On mélange 150 ml d'une solution de nitrate de magnésium Mg2+ et 2NO3- de concentration en soluté 1E-2 mol/L et 250 ml d'une solution de fluorure de sodium Na+ et F- de concentration 0,1 mol/L en soluté apporté. Les ions Mg2+ et F- peuvent réagir pour former un précipité
a) Ecrire l'équation de précipitation. J'AI REPONDU A CETTE QUESTION
on 2 F- + Mg2+ MgF2
MgF2
b)Calculer les concentrations initiales des ions Mg2+ et F- dans le mélange.En déduire la valeur initiale du quotient de réaction de précipitation J'AI REPONDU A CETTE QUESTION
D'abord, j'ai calculé les quantités de matières
On a
nF-= C(NaF) x V= 0,1 x 0,250= 0,025 mol
nMg2+ = C(Mg(NO3)[sub][/sub]) x V = 0,01 x 0,150= 0,0015
puis on peut calculer les concentrations dans le mélange
[F-]= 0,025/ (0,150+0,250)= 0,0625 mol/l
[Mg2+]= 0,0015/ (0,400) = 0,00375 mol/l
On calcule le Qr= 1/ ((0,0625)[sup][/sup] x (0,00375))= 68 266
c) La valeur de la constante d'équilibre associée à l'équation chimique de la dissolution (réaction inverse de la précipitation) du précipité MgF2 est de K'= 6,4E-9.
Peut-il y avoir formation du précipité MgF2 avec ces condition initiale ?
Je ne sais pas trop quoi répondre.
Tout d'abord, j'ai calculé l'inverse de K' et ainsi j'ai trouvé le quotient associé à la précipitation.
1/6,4E-9= 156 millions.
Soit le quotient de précipitation est plus grand que Qr initiale.
Donc la réaction se fait dans le sens direct soit il y a précipitation.
d) 1)Sachant que la précipitation est quasiment totale que valent l'avancement final et le taux d'avancement final de cette réaction ? En déduire la concentration du réactif en exçès.
2) Déterminer en reportant cette valeur dans la constante d'équilibre la concentration du réactif en défaut .
J'avoue que je suis perdue pour cette question je ne sais pas trop quoi faire
Ai-je le droit de dire que l'avancement final vaut x max at donc le taux d'avancement vaut 1 car la réaction est presque totale ?
Bonjour
1a) ok mais n'oublies pas de toujours indiquer en indice l'état physique de chaque composé...
1b) ok pour les concentrations !
Pour le Qr attention [F-] doit etre au carré !
1c) Explique simplement que comme on a Qr >> K la réaction se réalise dans le sens indirect de la dissolution de MgF2. Il y a donc bien précipitation de MgF2 !
1d) oui on peut faire l'approximation que le taux d'avancement vaut 1 !
En déduire la concentration du réactif en exçès.
je me dis que si le taux d'avancement vaut 1 alors xf= xmax environ.
donc on détermine x max en dressant un tableau d'avancement.
On en deduit la quantité de matière restante du reactif en excès.
De là, on a la concentration du reactif en excès.
Mais tout cela me pose probleme, car si je fais mes calculs avec x max normalement il n'y plus de reactif en défaut.
D'où, je ne peut calculer la concentration du réactif en défaut pour d) 2). Elle vaudrait 0 mol/l
Mais tu as forcément un réactif limitant vu que à l'état initial on a : n(Mg2+)<n(F-) !!!
Comment as-tu calculé ca ?
Oui, il y toujours un réacif limitant mais si je dis que xf=xmax alors la quantité de mayière que réctif limant à l'etat final vaut 0.
Le reactif limitant est Mg2+. x max= 1,5E-3
En effet
on a: nF- -2x=O d'où x max= 2,5E-3/2= 1,25E-2
ou bien nMg2+ -x=0 d'ou x max= 1,5E-3
Là on dit bien x max=1,5E-3 comme la réaction est quasi totale on dit que xmax=xf environ donc xf=1,5 E-3 mol non ?
Donc à partir de là je sai qu'il ne reste plus que
nF-= 2,5E-2 - 2x 1,5E-3=0,022 mol
d'ou la concentration du réactif en excès est de
[F-]=(0,022 / V)= 0,022/0,400= 0,055 mol/l environ
d) 2) On par de l'expression de K et on a K'= (([F-]*[F-]*[Mg2+))
On connait K' et [F-] que l'on vient de calculer et là on peut donc calculer [Mg2+] c'est ça ?
[F-]=(0,022 / V)= 0,022/0,400= 0,055 mol/l environ
d)
On par de l'expression de K et on a K'= (([F-]*[F-]*[Mg2+))
On connait K' et [F-] que l'on vient de calculer et là on peut donc calculer [Mg2+] c'est ça ?
Merci,
ensuite on me demande la masse du précipité obtenue. On sait qu'il se forme 1,5E-3 mol.
Donc à partir de là on peut calculer la masse avec la masse molaire .
Pourriez-vous corriger la suite de mon exercice?
On nous dit ensuite:
2° on introduit du fluorure de magnésium dans M volume V d'eau pure.
On considère que le précipité MgF2 peut se dissoudre jusqu'à ce que les concentrations en Mg2+ E f- satisfassent à l'expression de K.
a) On note xf l'avancement final de cette réaction de dissolution. Exprimer en fonction de xf et V les concentrations des ions en soluions.
on a dissolution donc [Mg2+]= xf/V
[F-]=(2xf)/ v
b) En exploitant l'expression de K en fonction des concentrations des ions en solution, en déduire xf en fonction de K et du Volume V
K= (2xf)/ V)(2xf)/ v)*xf/V
d'ou on a K= (4 xf*xf*xf)/ V^3
xf= la racine cubique de K*V^3)/ 4
K*V^3)/ 4
c)Quelle masse de fluorure de magnésium peut-on dissoudre dans 100ml d'eau ?
Je doute de ce qu'il faut faire:
Là, je pars de l'expression de xf je remplace le V par 100 ml en litre. j'ai le xf est à partir du xf je calcule la masse de MgF2?
On imagine que xf= nMgF2 comme ca tout est dissous
2a) ok
2b) oui ca donne donc : xf = V 3
3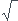
2c) oui c'est ca qu'il faut faire ! Puisque la solubilité de MgCl2 (c'est-à-dire la quantité maximale de MgCl2 que l'on peut dissoudre) vaut xf !
Il faut donc que tu calcules xf (qui vaut alors n(MgCl2)) et que tu en déduises m(MgCl2).


