Inscription / Connexion Nouveau Sujet
Piles
Bonjour,
On crée une pile à partir des 2 couples rédox suivants : Fe2+ (aq)/Fe(s) et Au3+ (aq)/Au(s) par
une solution de sulfate de fer FeSo4 et d'une solution de chlorure d'or AuCl3 chacune à c = 0,1 mol.L-1 . Les deux
compartiments liés au fer et à l'or sont reliés par un pont salin d'une solution de sulfate de potassium de
c=1,0 mol.L -1 . Les ions sulfate du pont salin vont vers le compartiment du fer.
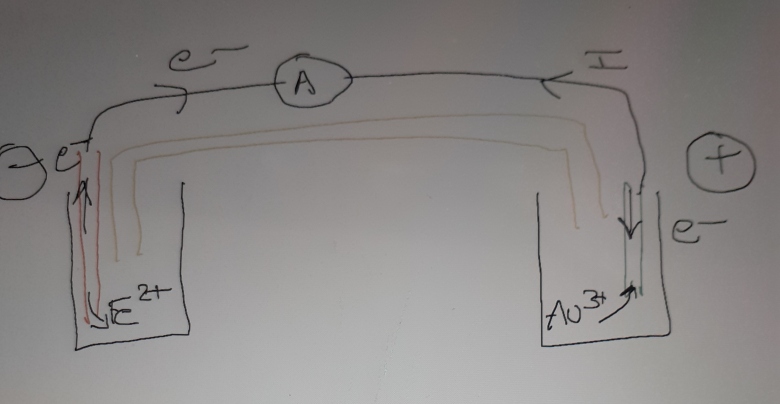
1. Réaliser un schéma de la pile.
2. Donner les espèces crée/disparue dans chaque compartiment.
3. Donne les équations des réactions d'électrodes. Quelle est l'espèce réduite et oxydée
Fe2+(aq) + 2e --> Fe(s)
Au(s) --> Au3+(aq) + 3e-
le fer est réduit et l'argent est oxydée
4. Donne l'équation de réaction modélisant le fonctionnement de la pile.
3Fe2+(aq) + 2Au(aq) --> 3Fe(s) + 2Au3+(aq)
5. Dire où est la cathode et anode
cathode : pôle + et anode : pôle -
6. Représenter le déplacement des porteurs de charges dans l'ensemble du circuit.
7. Donner le rôle double du pont salin ?
Le pont salin permet la circulation du courant et équilibrer les charges
Bonjour,
Première remarque : FeSO4 et AuCl3 ne sont pas des solutions ioniques mais des solides ioniques : ![]() [lien]
[lien]
1. Où est le schéma de principe de cette pile ?
2. Où sont tes réflexions ?
3. 4. et 5. Tu n'expliques pas ce que tu fais !
Je te conseille de jeter un coup d'oeil à cette fiche : ![]() [lien]
[lien]

Bonjour Devoirs33,
Désolé, j'étais en vacances ces derniers jours :
1. Je t'ai déjà dit maintes fois dans d'autres sujets traités ensemble qu'il faut justifier ce que tu fais ... Peut-être que ça peut passer au bac mais ça sera 0 dans le supérieur, autant donc s'entraîner tout de suite, tu ne crois pas ?
Pour justifier ton schéma de principe (qui en plus est correct !), il faut exploiter ceci :
Les ions sulfate du pont salin vont vers le compartiment du fer
2. Tu n'as pas répondu à la question !
3.
Fe2+(aq) + 2e --> Fe(s)
Au(s) --> Au3+(aq) + 3e-
le fer est réduit et l'argent est oxydée
Regarde ton schéma et tu verras que c'est complètement faux.
Comme écrit dans la fiche que je t'ai fournie,
Les solutions ioniques sont le siège d'un double déplacement d'ions :
 les anions se déplacent vers l'anode, en sens inverse du courant ;
les anions se déplacent vers l'anode, en sens inverse du courant ; les cations se déplacent vers la cathode, dans le sens du courant.
les cations se déplacent vers la cathode, dans le sens du courant.Et par principe :
- l'oxydation se fait à l'anode ;
- la réduction se fait à la cathode.
Révise cette fiche pour la notion d'oxydation et de réduction :
4. A reprendre
5. OK
6. OK mais il manque le déplacement des ions sur ton schéma
7. OK.