Inscription / Connexion Nouveau Sujet
pH de fleurs
Bonsoir à tous,
j'ai un exercice à faire pour le retour des vacances auquel je bloque, c'est pourquoi j'aimerai avoir votre aide svp. J'ai beaucoup cherché mais je suis bloqué à la question n°5, je vais vous mettre l'énoncé, ainsi que les réponses.
Certaines fleurs possèdent des pigments naturels dont la couleur dépend du pH. La couleur violette est due à une molécule amphotère que l'on note AH(aq).
1) Ecrire l'équation de la réaction de AH(aq) en tant qu'acide avec l'eau.
AH(aq) +H2O A-(aq) +H3O+(aq)
2) Donner l'expression de la constante d'équilibre KA2 de cette réaction, puis la calculer.
Par définition Ka = 10-pKa, d'après l'énoncé pKa2 = 7,0 alors Ka2 = 10-
7.0 = 1.10-7
3) Le pH d'une solution contenant AH(aq) est égal à 10. Exprimer littéralement le rapport et en déduire la couleur de la solution.
J'ai fait une équation mais j'ai un problème je sais pas si le début si c'est Ka ou Ka2 donc j'ai fait :
d'ou
d'ou
On a un pH de 10 donc j'en ai déduis que la concentration d'H3O+ = 10^-pH = 10-10 et Ka j'ai pris Ka2 que j'ai trouvé précédemment donc :
ce rapport est inférieur à 1 alors [A^-] >[AH] alors A^- prédomine la couleur est donc bleu.
Est-ce que c'est bon si j'utilise le Ka2 pour faire la rapport ?
4) Ecrire l'équation de la réaction de AH(aq) en tant que base avec l'eau.
5) Donner l'expression de la constante d'équilibre de la réaction en fonction de Ka1.
Je bloque à cette question
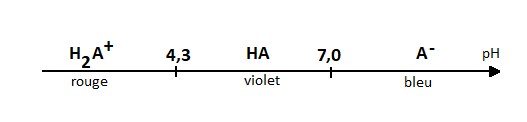
6) Réaliser le digramme de prédominance des espèces AH2+(aq) AH(aq) et A-(aq)
7) Déterminer le domaine pH pour lequel la molécule est bleue.
Données :
Pka des espèces colorées : pKa1 = 4,3 et pKa2 = 7,0
Couleur de AH2+(aq) : rouge
Couleur de AH(aq) : violette
Couleur A-(aq) : bleue
Merci d'avance pour votre aide
Bonjour,
Questions 1 à 3 : OK
Question 4 : Ta réponse ne correspond pas à la question posée : Réaction de AH en tant que base avec l'eau
Presque .....
Ta deuxième proposition ne respecte pas la conservation de l'élément Hydrogène.
AH (base) capte un ion H+ et devient ...........
Oui c'est exact.
L'énoncé précise que AH est une molécule amphotère.
AH appartient donc à deux couples acide / base différents qui sont AH2+ / AH ( dans lequel AH est une base ) et AH / A- ( dans lequel AH est un acide )
Réaction de AH sur l'eau en tant qu'acide :
AH(aq) + H2O(l) ⇆ A-(aq) + H3O+(aq)
Réaction de AH sur l'eau en tant que base :
AH(aq) + H2O(l) ⇆ AH2 +(aq) + HO-(aq)
D'accord merci beaucoup, en revanche je ne vois pas comment faire à la question 5.
Avec l'équation précédente on en déduit Ka =
Mais je dois écrire cette expression en fonction de KA1.
Je sais que KA1 = 10-pKa, je peux éventuellement remplacer par les valeurs mais ça m'avance à rien...
Vous voyez j'ai trouvé 2 expressions différentes du pKa mais est-ce qu'il faut les associés ? Car on a du Ka1 et Ka2 et 2 équations de réaction en milieu basique et en milieu acide avec l'eau.
L'expression n'est pas, comme tu as l'air de le penser, une constante d'acidité.
Le terme de constante d'acidité est réservé à la constante d'équilibre de la réaction d'un acide (faible) avec l'eau donc ici à la réaction de l'acide AH2+ avec l'eau
Oui.
Cette constante est parfois appelée constante de basicité, mais peu importe.
Pour toi, c'est seulement la constante d'équilibre attachée à la réaction
AH(aq) + H2O(l) ⇆ AH2 +(aq) + HO-(aq)
Constante de basicité pour la constante d'équilibre de la réaction d'un acide fort avec de l'eau, c'est bien ça ?
Je dois me servir de cette constante pour la question 5 ?
De la même manière que la constante d'acidité se définit comme la constante d'équilibre de réaction d'un acide (faible) avec l'eau on utilise parfois le terme de constante de basicité comme la constante d'équilibre de la réaction d'une base (faible) avec l'eau
Toutefois tu peux oublier ce terme de constante de basicité, il n'est pas utile ici.
L'énoncé de la question 5 indique ce que tu as à faire :
" Donner l'expression de la constante d'équilibre de la réaction en fonction de Ka1. "
Pour être plus clair on pourrait préciser :
" Donner l'expression de la constante d'équilibre de la réaction trouvée à la question 4 en fonction de Ka1. "
D'accord donc si j'écris pour commencer la constante d'équilibre de la réaction trouvé à la question n°4 :
K =
Mais je ne comprends Ka1 correspond à quelle réaction?
Comme déjà indiqué ( 28-12-21 à 10:05 ) AH est une espèce amphotère qui appartient à deux couples
acide / base différents qui sont AH2+ / AH et AH / A-
Ka1 est la constante d'acidité du couple AH2+ / AH
On a donc Ka1 = ....................
D'accord donc Ka1 =
Mais vous m'avez dit que ce n'est pas une constante d'acidité, et je dois écrire une constante d'équilibre alors pourquoi on me demande en fonction de Ka1 ?
Donc je ne comprends pas : je dois écrire la constante d'équilibre en fonction de Ka1 donc c'est bon ce que j'ai fais ? parce que on veut la constante d'équilibre de la réaction donc avec l'eau donc celle déterminé à la question n°4.
Merci
Ne me fais pas dire ce que je n'ai pas dit !
J'ai dit et je persiste à dire que
K = n'est pas une constante d'acidité parce que cette constante d'équilibre est associée à la réaction AH(aq) + H2O(l) ⇆ AH2 +(aq) + HO-(aq) laquelle n'est pas une réaction entre un acide et l'eau.
En effet, dans cette réaction l'espèce AH joue le rôle d'une base.
Cela n'empêche pas de définir la constante Ka1 comme une (vraie) constante d'acidité relative à le réaction entre l'acide AH2+ et l'eau :
AH2+ + H2O ⇆ ............................................
Donc Ka1 = ..............................................
D'accord, vous me l'apprenez.
Ensuite je met le H3O+ à gauche ça donne donc:
= > 1 alors AH prédomine donc la couleur violette prédomine.
Je peux maintenant établir le diagramme de prédominance ? ( question n°6)
Question 5 :
Je te conseille de relire la question avant d'essayer d'y répondre ....
On te demande d'exprimer la constante K en fonction de Ka1
Rappel :
K = Ka1 =
donc .....
[H3O+] × [HO-] = [H3O+ ]² et pour le justifier je peux citer les équations établit de AH avec l'eau en tant qu'acide et en tant que base.
On a donc : K = c'est donc < 1 alors Ka1 "prédomine".
Ensuite, on sait que Ka1 = alors AH2+ prédomine donc je peux en déduire que la couleur rouge prédomine ?
Je peux continuer ? Cela me semble suffisant pour établir le diagramme de prédominance, on a 2 pKa donc 3 prédominances possibles, j'en ai trouvé 2... Je peux deviner la 3ème ( son intervalle )
Question 5 :
Tu as l'air d'ignorer que le produit [H3O+] × [HO-] est connu sous le nom de produit ionique de l'eau et qu'il est noté Ke
A 25°C Ke = 10-14
Dans le cas général il est faux d'affirmer que [H3O+] × [HO-] = [H3O+ ]²
Ce n'est vrai que pour les solutions neutres de pH=7
La réponse à la question 5 est donc :
K = Ke / Ka1
Aucun calcul numérique n'est demandé, mais il est possible d'en déduire la valeur de K puisque celles de Ke et de Ka1 sont connues
Ah d'accord je comprend, enfaite je cherchais depuis le début à trouver une valeur de K pour établir le digramme de prédominance mais je me suis rendu compte qu'il n'y a en avait pas besoin de valeur de K.
Pour ce digramme je le trace, je met les pKa que je possède soit pKa1 = 4.3 et pKa2 = 7.0 et enfin le pKe a 25°C = 14.
Ensuite je met AH2+ à gauche c'est à dire entre 0 et pKa1 qui prédomine sur cet intervalle = couleur rouge qui prédomine.
Je met AH entre pKa1 et pKa2 qui prédomine sur cette intervalle = couleur violette qui prédomine.
Et pour finir je met A- sur pKa2 et pKe qui prédomine sur cette intervalle = couleur bleue qui prédomine.
J'en déduis alors que le domaine du pH auquel la molécule est bleue ( question n°7) qui est "l'intervalle" [pKa2;pKe].
Est-ce correct ?
Pourquoi ma dernière proposition est fausse ? Vous avez dit la couleur est bleu pour pH > pKa2 mais si on parle d'intervalle c'est bien [pKa2; pKe] non ?
Ah d'accord, en tous cas je vous remercie beaucoup pour votre aide. En vous souhaitant une bonne année. 
Bonjour,
Une question à odbugt1 :
Dans la question 3) on nous dit que le PH d'une solution d'AH(aq) est 10 ; donc la couleur de la solution est bleue, en accord avec le diagramme ;
A température constante, que faudrait il faire pour avoir une autre couleur, par exemple violette ou rouge ? Mon avis : si on modifiait la concentration d'AH(aq)?
Merci d'avance
Pour une solution bleue, donc de pH >7 il suffit d'ajouter une quantité définie de solution acide ( en général chlorhydrique ) afin de ramener le pH entre 4,3 et 7 ( solution violette ) ou inférieur à 4,3 (solution rouge)