Inscription / Connexion Nouveau Sujet
petites questions sur l'état d'équilibre
bonsoir à tous
j'aurais quelques questions à vous poser concernant l'état d'équilibre :
1. est ce que seules les transformations limitées ont un état d'équilibre ?
2. à l'état d'équilibre est ce que les concentrations de tous les réactifs et produits sont égales ?
3. dans mon cours il est dit que quand un système est à l'état d'équilibre il suffit de modifier les contraintes extérieures (exemple : ajouter un réactif ou un produit) pour permettre le déplacement de l'équilibre. Mais à quoi cela sert-il ? Et aussi que veut dire "déplacer l'équilibre" (il y a plus de réactifs que de produits ? plus de produits que de réactifs ? on ne peut pas savoir ? ca dépend de ... ? ou autre chose ?)
4. quand on écrit une équation de réaction comment savoir si on doit mettre une flèche -> entre réactifs et produits ou si on doit mettre un signe = ?
merci d'avance pour vos réponses.
salut
1) non ! toutes les transformations chimiques ont un état d'équilibre. Mais les transformations totales ont une constante d'équilibre très grande, ce qui fait qu'il y a un réactif qui a presque disparu complètement à l'équilibre ( on considère généralement qu'il n'y a plus du tout de réactif limitant dans ce cas)
2) non ! tout dépend des concentrations initiales et des coef stochiométriques
3) pour répondre à ça il faut comprendre comment se déroule une réaction chimique. tu dois savoir qu'on peut définir un quotient de réaction Q qui se calcule à partir des quantités produits/réactifs. Quand la réaction se déroule, Q change puisqu'on consomme des réactifs et qu'on produit des produits. Q se déplace toujours vers K la constante d'équilibre de la réaction. Quand Q=K , l'équilibre est a atteint ! la réaction n'avancera plus sauf si on fait quelque chose. Par exemple si on ajoute des réactifs, on diminue Q ! Donc la réaction va réagir en reconsommant des réactifs pour que son Q revienne vers K. C'est ça déplacer l'équilibre
4) les flèches sont pour les réactions totales, les = pour les réactions limitées
voilà j'espère que ça t'avance un peu
Ca m'avance même beaucoup ! Merci pour tes réponses, tes explications sont très claires surtout pour la question 3, j'ai tout compris. Cependant, mettre un signe = c'est pas quand une réaction a lieu dans les deux sens ? A moins que "réaction ayant lieu dans les deux sens" est équivalent à "réaction limitée"...
mais j'ai encore une question : comment savoir si une réaction est totale (sans calculer le taux d'avancement) ?
je t'explique, dans les exercices quand on demande d'écrire l'équation d'une réaction par exemple entre CH3COOH et HO- moi je mets une flèche (alors qu'en fait c'est = ) et le prof me compte la réponse comme fausse.
mais ensuite seulement, dans une question ultérieure, on me demande de calculer le taux d'avancement et évidemment je trouve 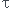 < 1 donc il aurait fallu que je mette = dans la réaction mais je n'étais pas censé le savoir puisque j'ai dû calculer
< 1 donc il aurait fallu que je mette = dans la réaction mais je n'étais pas censé le savoir puisque j'ai dû calculer 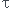 après avoir écrit l'équation de réaction.
après avoir écrit l'équation de réaction.
je ne sais pas si je me suis clairement exprimé si tu veux je peux reformuler mon problème si tu ne comprends pas. merci encore pour tes réponses.
alors je vais essayer de répondre à toutes tes questions :
- on ne peut pas savoir à "l'intuition" si une réaction est totale ou non. Par expérience, on peut savoir que telle type de réaction est totale et quel type ne l'est généralement pas. Mais si on ne te donne pas K ou si on ne te le dit pas tu n'es pas censé le savoir ! Tu dois savoir simplement certaines petites choses, par exemple que les réactions qu'on utilise pour les dosages sont obligatoirement totales. Ca peut tomber en question dans une interro
- il est plus grave de mettre une flèche alors que c'est un égal que de mettre un égal alors que c'est une flèche ! donc mon conseil est le suivant : à partir de la terminale, laisse tomber les flèches et met des égals presque partout


