Inscription / Connexion Nouveau Sujet
Le rayon de Bohr
Bonjour, j'aimerais de votre aimable
Que vaut le rayon de Bohr dans l'atome d'hydrogène à l'état fondamental ?
Je sais que les images sont interdites mais vu la taille du sujet je ne pouvais pas vraiment me permettre de tout recopier et je ne voulais pas omettre des données.
Je sais qu'à l'aide de la relation je peux trouver d²= (K * |q1-q2|)/FE
En revanche je ne sais pas à quoi peuvent servir les formules du document 4 pour trouver FE
Merci d'avance, bonne journée 
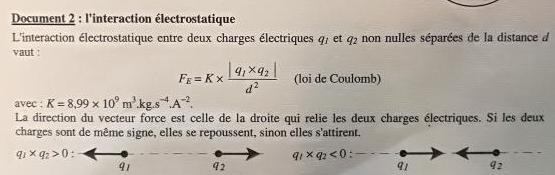
***Image recadrée***
Hello
Sans considération sur le mauvais goût de tes remarques postées sur d'autres messages
"Je sais qu'à l'aide de la relation je peux trouver d²= (K * |q1-q2|)/FE "
J'ai du mal à cerner ce que tu sais  mais tu retranscris avec une erreur l'expression fournie par le document 1:
mais tu retranscris avec une erreur l'expression fournie par le document 1:
"En revanche je ne sais pas à quoi peuvent servir les formules du document 4 pour trouver FE"
Le en revanche est inapproprié puisque ce qu'il y a par ailleurs, tu ne sembles pas le savoir non plus 
Plus sérieusement, l'énoncé te demande de justifier que l'on ne se trouve pas dans le cas relativiste, c'est à dire que la vitesse de l'électron est suffisamment faible pour ce contenter de l'expression de la été de mouvement
Pour t'aider:
1) tu exprimes la 2nde loi de Newton qui te permettras de lier l'expression de FE à la vitesse de l'électron
2) tu exploites le document 3 pour relier le rayon de la trajectoire à la vitesse de l'électron dont la caractéristique ondulatoire est donnée par la longueur d'onde de De Broglie
3) tu isoles v dans ces 2 équations et identifies les seconds termes ... tu auras trouvé l'expression du rayon de Bohr
Bonsoir,
Tu as peut-être la "flemme" d'aider d'autres membres mais tu auras à recopier ton énoncé d'exercice (tu pourras juste insérer le schéma du modèle de Bohr).
Seuls les sujets de concours de plusieurs pages sont exemptés d'une recopie.
Merci
Seconde loi de Newton
Dans le modèle de Bohr la trajectoire de l'électron est circulaire uniforme, donc
où Q1 est le point représentant le centre du noyau, supposé immobile
et Q2 est le point représentant l'électron
Soit Q1Q2 = r, rayon que l'on cherche à déterminer
Donc ici , avec q1 = -q2 = +e , (1) devient:
Soit
Par ailleurs, il est indiqué dans l'énoncé que la longueur d'onde associée à l'électron dans son état fondamental (correspondant au rayon de Bohr donc) était égale à la circonférence de son orbite.
Donc où h est la constante de Planck et p la quantité de mouvement de l'électron
On suppose l'électron non relativiste (on le vérifiera ensuite). Dans ce cas:
Donc
Soit
Et en identifiant (2) et (3) on obtient:
Soit
Partant de là tu peux réinjecter dans (2) ou (3) pour trouver v
Le calcul numérique te fournit une valeur en 106 m/s ce qui justifie le choix précédemment fait de se placer dans le cadre non relativiste (v << c donc 
 1)
1)


