Inscription / Connexion Nouveau Sujet
La qualité de l'eau
Bonjour, je m'entraîne pour le bac et j'aimerais comprendre cette exercice.., je n'arrive plus à comprendre à partir de la question 3, pouvez-vous m'aider s'il vous plaît ?
Voici l'énoncé :
L'Artémia est le nom scientifique d'un petit crustacé qui possède la particularité de pouvoir vivre dans des milieux très salés et tel que certains lacs et marais salants. Pour se développer les artémias ont besoin de vivre dans un milieu marin dans la teneur moyenne en ions chlorure Cl- est supérieure à 30 g.L-1. Dans ces conditions, leur développement n'est pas compromis car les prédateurs aquatiques ne supportent pas des conditions salines aussi élevées. Avant d'implanter un élevage d'Artémias dans des marais salants du sud de la France, on se propose de déterminer la concentration en ions chlorure d'un prélèvement d'eau d'un marais de la zone choisie. Cette eau contient exclusivement des ions sodium et des ions chlorure. La méthode utilisée permet de doser les ions chlorure par précipitation avec les ions argents Ag+. La réaction de précipitation (Ag+) +( Cl-) -> AgCl peut être considéré comme totale.
En septembre 2019 après un été caniculaire, on a prélevé un échantillon d'eau dans un marais salant, de la zone prévu pour implanter de l'élevage d'Artémias. On souhaite diluer 10 fois cette eau pour obtenir la solution S1 à doser.
Voici les questions :
1-Pour obtenir 50 mL de solution S1, quel volume doit-on prélever ?
Ma réponse : Vm= 50/10=5mL
2-Lister la verrerie à utiliser pour effectuer cette dilution. Expliquer le mode opératoire.
Ma réponse : Verrerie: pipette jaugée et fiole jaugée.
Mode opératoire : - Prélèvement de 5mL d'eau dans la solution mère (échantillon d'eau dans un marais salant) à l'aide d'une pipette jaugée.
-Ajout du prélèvement des 5 mL dans la fiole jaugée.
On réalise ensuite le dosage d'un volume
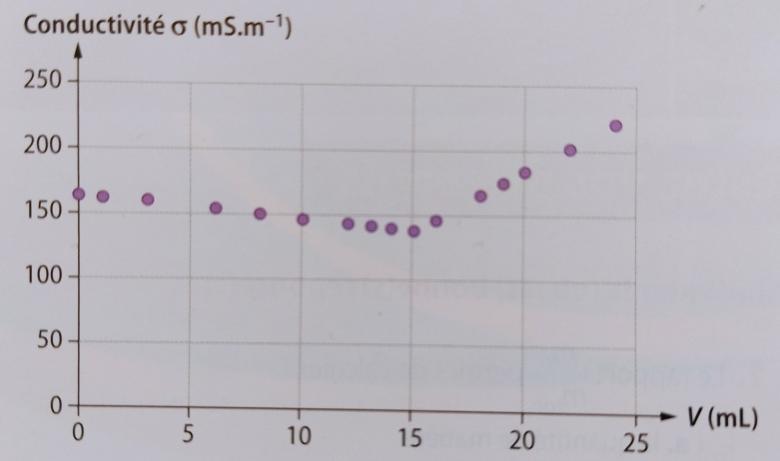
V1 = 10 mL de solution S1 par une solution S2 de nitrate d'argent de concentration C2 = 1.00 * 10 ( puissance -1) mol.L-1. La courbe obtenue est la suivante:
( Courbe en pièce jointe )
( Et à partir d'ici je n'arrive plus a comprendre..)
3- A l'aide de la courbe, montrer que le volume à l'équivalence est de 15,2 mL.
4- Déterminer la concentration en quantité de matière d'ions chlorure dans la solution S1.
Formule : C= n/V
5- En déduire la concentration en masse d'ions chlorure dans l'eau du Marais.
Formule : Cm= m/V
6- Cette eau est-elle favorable au développement des Artémias?
Donnée: M (Cl)= 35.5 g.mol-1
Bonjour,
Question 1:
OK
Question 2:
Ta description correspond au transfert de 5mL de solution, mais pas à sa dilution.
Question 3:
Impossible de t'aider si tu ne postes pas la courbe.
Question 2 :
Compte tenu de ma remarque, que proposes tu pour répondre correctement à cette question ?
Question 3 :
Le volume à l'équivalence correspond à l'abscisse du point pour lequel il se produit un changement de pente dans le graphique fourni par l'énoncé.
Que vaut ce volume ?
Question 2:
Mettre la solution mère dans un bécher. A l'aide d'une pipette jaugée prélever 5 mL cette solution mère.
Verser le prélèvement dans une fiole jaugée pour créer une solution fille.
Compléter avec de l'eau distillée.
Boucher la fiole à l'aide d'un bouchon et agiter pour homogénéiser l'ensemble.
Question 3:
140 mS.m-1
Question 2 : OK
Question 3 :
Non.
De plus, il semble que pour toi, un volume s'exprime en mS/m ! ! !
Ci dessous schéma pour t'aider à répondre correctement ( en rédigeant une phrase, c'est la moindre des choses)
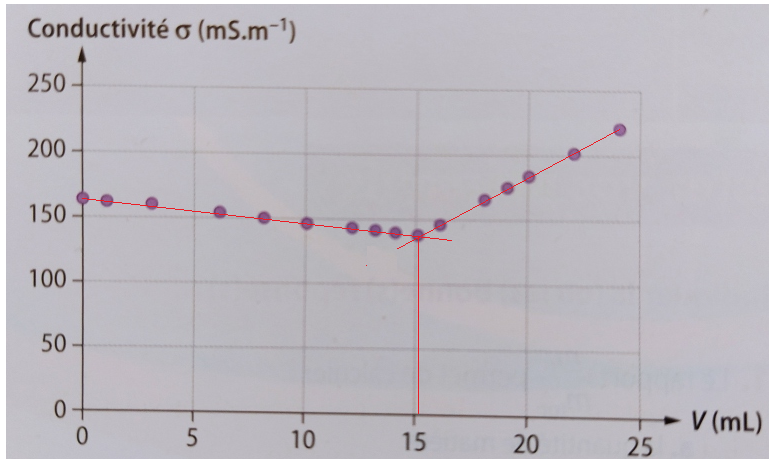
Question 3:
Ce volume vaut 15.2 mL. Entre 0 et 15.2 mL, la conductivité est comprise entre 160 et 140 mS/m. Puis il y a une augmentation de la conductivité à partir de 15.2 mL à 24 mL, elle passe de de 140 à 225 mS/m.
Oui, le volume équivalent vaut bien 15,2 mL
Les valeurs observées pour la conductivité sont ici sans intérêt.
Le schéma, tel que je l'ai complété sert de justification à la question 3
Merci à vous.
Est ce que pour la question 4 ma formule est la bonne car je n'arrive pas à trouver les bonnes valeurs pour celle-ci et c'est aussi le cas pour la question 5...?
Les "formules" prises au petit bonheur ne permettent pas de résoudre tous les exercices.
On a ici affaire à un dosage :
a) Que dose t'on ?
b) Avec quoi le dose t'on ?
c) Quelle est l'équation bilan de la réaction qui sert de support au dosage ?
d) Quels sont les réactifs de cette équation bilan ?
e)Quel est le réactif titrant ? Quelle est sa concentration ?
f) Quelle est la particularité du point d'équivalence ?
Aucune de ces questions ne nécessite de formule.
Y répondre est destiné à comprendre l'énoncé
***Edit gbm : cette fiche peut s'avérer utile pour cela : ![]() [lien]
[lien]  ***
***
a)On dose la concentration en quantité de matière d'ions chlorure dans la solution S1.
B) On le dose grâce à un dosage conductimétrique. On dose les ions chlorure par précipitation avec les ions argent Ag+.
C)L'équation bilan de la réaction qui sert de support au dosage est :
Ag+ (aq) + Cl- (aq) -> AgCl (s)
D) les réactifs de cette équation bilan sont les ions chlorure et ions argent.
E) Le réactif titrant est le nitrate d'argent, de concentration 1.00 × 10-1 mol.L-1.
F) la particularité du point d'équivalence est que à partir de 15.2 mL, la nitrate d'argent ne réagit plus avec la solution S1.
Je ne sais pas si j'ai bien compris la dernière question..
Bon, ce n'est pas mal du tout.
Le réactif titrant : Plutôt les ions Argent que le nitrate d'argent car les ions nitrate sont présents, mais ne participent pas à la réaction.
Continuons :
Quelle quantité de matière (en mol) d'ions Argent a été introduite lorsque le point d'équivalence est atteint.
Je n'arrive pas à trouver.. je voulais utiliser la formule n= m ( g) / M (g.mol-1), mais je crois que ce n'est pas cela...
Car c'est une des formules pour trouver la quantité de matière.
Ou je dois peut être utilisée celle qui permet de savoir la quantité de matière dans une solution donc n= C×V
n= 1.00 × 10 -1 × 15.2
= 1,52 mol
Ou je dois peut être utilisée celle qui permet de savoir la quantité de matière dans une solution donc n= C×V
n= 1.00 × 10 -1 × 15.2
= 1,52 mol
C'est la bonne méthode, mais il faut faire attention aux unités.
Puisque la concentration est exprimée en mol/L, le volume de la solution titrante doit être exprimé en litres.
Je te laisse corriger
C'est donc 1.00 × 10 -1 × 0.0152
= 1,52× 10-3
Hélas !
Que désigne le " C' " par lequel débute ta réponse ?
T'as t'on déjà dit qu'un résultat numérique sans unité n'a strictement aucune signification ?
Merci de soigner tes réponses !
n= 1.00 × 10 -1 × 0.0152
= 1,52× 10-3 mol
La quantité de matière d'ions Argent qui a été introduite lorsque le point d'équivalence est atteint est de 1,52× 10-3 mol.
Nous sommes d'accord.
Pour être précis on désignera cette quantité de matière par n(Ag+) et on aura donc n(Ag+) = 1,52 . 10-3 mol
De ce résultat on peut, en utilisant l'équation bilan, déduire la quantité de matière en ions chlorure qui ont réagi avec les 1,52 . 10-3 mol d'ions argent lorsque le point d'équivalence est atteint.
A ton avis : n(Cl-) = .............. (Penser à justifier)
n( Cl-) = 1,52 . 10-3 * 0.0152 = 2.3104*10-5 mol
Je ne serais pas justifié... C'est une proposition je ne suis pas sûr de moi...
L'équation bilan est : Ag+(aq) + Cl-(aq)  AgCl(s)
AgCl(s)
Elle montre que les ions Ag+ et les ions Cl- réagissent en quantité égales.
A l'équivalence n(Cl-) = n(Ag+) = 1,52 . 10-3 mol
10 mL de solution S1 contiennent 1,52 . 10-3 mol en ions Cl-
Connaissant le volume et la quantité de matière de S1, un calcul très simple permet de répondre à la question posée.
Oui, bien sûr puisque c'est ce que j'explique dans mon post du 19-10-20 à 23:17
Relis la question 4 : Elle porte sur la concentration (et non sur la quantité de matière) de S1 en ions Cl-
C= n/V
C= 1.52.10-3 * 0.010 = 1.52*10-5 mol.L-1
La concentration de S1 en ions Cl- est de 1.52*10-5 mol.L-1.
Excusez moi, c'est
C= 1.52.10-3 / 0.010 = 1.52*10-3mol.L-1
Tu devrais relire tes réponses :
En divisant 1,52 . 10-3 par 0,01 tu ne peux évidemment pas retrouver 1,52 . 10-3 !
Je sais dans ce cas là on divise par 10 et non par 0.010 alors ? Car de base le volume est en litres...c'est pour cela que j'ai divisé par 0.010..
Merci à vous, et pour la question 5 pouvez- vous m'aider, je serais faire la question 6 seule je pense.
Relis l'énoncé. Notamment au sujet du passage de l'eau du marais à la solution S1
Tu connais maintenant la concentration molaire en ions chlorure de la solution S1
Tu devrais pouvoir en déduire par un simple calcul mental la concentration molaire en ions chlorure de l'eau du marais.
Cela fait, il ne te restera plus qu'à passer de cette concentration molaire à la concentration massique demandée.
Remarques sur le vocabulaire employé :
Ma "concentration molaire" est appelée ici "concentration en quantité de matière"
Ma "concentration massique" est appelée ici "concentration en masse"