Inscription / Connexion Nouveau Sujet
force acide/base
 cwetcode13
cwetcode13Bonjour à tous! quelqu'un aurait-il la gentillesse de m'aider à résoudre cet exercice ?
Un laboratoire réalise la synthèse de l'éthanoate de benzyle C9H10O2 (l) en chauffant un mélange de
V1 = 5,7 mL d'acide éthanoïque CH3COOH(l) et V2 = 10,3 mL d'alcool benzylique C7H8O(l).
Equation de la réaction : CH3COOH(l) + C7H8O (l) = C9H10O2 (l) + H20 (l)
La constante de la réaction vaut K = 10^3
Remarque : Ici l'eau n'est pas un solvant, car toutes les espèces sont des liquides purs. L'eau est un produit de la réaction comme un autre, et on peut définir sa concentration [H20] = n(H20)/V
Le volume V de liquide reste identique au cours de la synthèse. Au bout de t1 = 10 min, on réalise le titrage de l'acide CH3COOH (L) restant et on obtient n_acide(t1) = 0,070 mol.
Données : Masses molaires : M(C) = 12 g.mol-1. M(H) = 1,0 g.mol-1 M(0) = 16 g.mol-1
Masses volumiques : p(acide éthanoïque) = 1,049 g.cm^-3 et p(alcool benzylique) = 1,045 g.cm^-3
1)Établir le tableau d'avancement de la réaction et déterminer les quantités de matière de toutes les espèces chimiques présentes à l'instant t1.
2)Exprimer et calculer le quotient de réaction Qr(t1) à l'instant t1.
L'équilibre est-il atteint ? comment va évoluer la réaction ?
3) À l'instant t2 = 1h, on a atteint l'équilibre. La quantité d'acide restant vaut alors n_acide (t2) = 0,033 mol. Calculer le taux d'avancement final t. La transformation est-elle totale ?
Alors voilà, pour la 1) j'ai quelques lacunes pour faire un tableau d'avancement que je vous montre en pièce jointe..
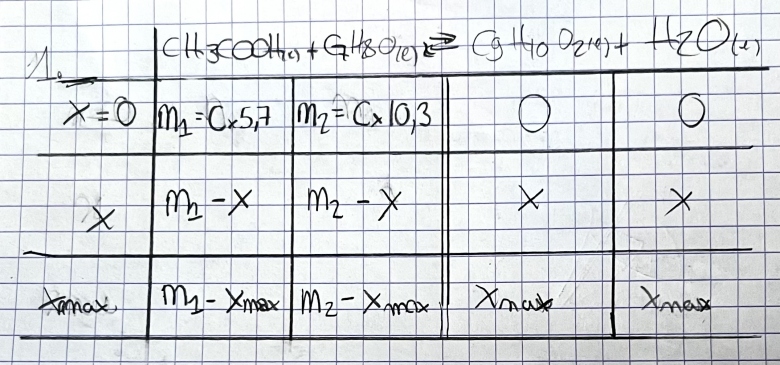
Bonjour
Petit conseil préliminaire : il faut absolument lire la totalité de l'énoncé avant d'aborder la première question : ce n'est pas du temps perdu : bien souvent la fin de l'énoncé fournit des indications utiles à la résolution des premières questions. C'est le cas ici : à la lecture de la question 3, il est clair que l'équilibre n'est pas atteint à la date t1 puisqu'il le sera seulement à la date t2. La troisième ligne de ton tableau n'a donc pas de sens ici. De plus, l'énoncé fournit à la date t1 la valeur de la quantité d'acide que tu as noté (n1-x). Tu peux donc calculer x après avoir calculé n1 puis compléter le tableau après avoir aussi calculé n2.
Tes calculs de n1 et de n2 sont à revoir. Les deux réactifs ne sont pas en solution aqueuse. L'état initial correspond au mélange de deux liquides : de l'acide éthanoïque pur et de l'alcool benzylique pur : cela est rappelé par l'énoncé ! Pour calculer les quantités, il faut utiliser les données de l'énoncé.
Je ne sais pas si tu l'as remarqué : il s'agit ici d'étudier une réaction d'estérification. Par rapport à l'étude habituelle faite en cours, on a juste changé l'alcool...
A la date t1, tu as simplement :
n1-x=0,070mol : la quantité présente d'acide est fournie dans l'énoncé. Une fois calculée n1, tu obtiens directement la valeur de x...
Oui ! Il te faut maintenant calculer n1 et n2 à partir des volumes, des masses volumiques et des masses molaires.
donc on connaît c=n/v donc n=c*v
d'après les données qu'on nous donne on utiliser la formule n=m/M
donc on utilise la formule C=m/v*M ?
C'est ce que je pensais faire aussi!
donc on aurait C=0,021mol/L
n=c*V=0,021*0,0057
n=1,2*10^-4 mol/L
cela est correcte?
Si vous vous mettez à deux pour introduire des erreurs au lieu de lire attentivement l'énoncé et mes messages (ceux du 29-01-23 à 21:49 et du 29-01-23 à 12:36 en particulier) : je vous laisse vous débrouiller ! 
Je me répète : il faut bien lire l'énoncé. Il ne s'agit pas ici de solution aqueuse où on déduit la quantité de matière de la concentration et du volume de la solution. D'ailleurs aucune concentration n'est fournie. En revanche, comme déjà écrit :Il faut maintenant calculer n1 et n2 à partir des volumes, des masses volumiques et des masses molaires. Ce sont des valeurs fournies pour l'acide et pour l'alcool. Tu dois connaître la méthode depuis la première ! Voir par exemple le paragraphe III de cette fiche : ![]() [lien]
[lien]
Vous ne nous aidez pas vraiment a part nous indiquer des choses en surface sans approfondir..
j'ai calculer C car on ne la connaît pas à partir de « m » « M » et « V »
puis j'ai appliqué la formule n=C*V pour trouver n1
qu'il y'a-t-il de faux ??
Dans ton tableau d'avancement, tu as besoin des valeurs de n1 et de n2. Pourquoi refuses-tu de le reconnaître et de fournir le calcul en conséquence ?
oui mais je demandais simplement si le calcul de n1 était correct afin que j'utilise la même formule pour n2
c'était juste pour savoir pas que je fasse 2 fois la même erreur si ma formule est fausse



