Inscription / Connexion Nouveau Sujet
Extraction de la vanilline
Bonsoir,
J'ai un dm à faire, j'ai commencé mais je bloque sur la 2ème partie, je vous l'écris :
Exprimer la concentration molaire C1 en vanilline de la solution F1 en fonction de m, V0, V1, V2 et de la masse molaire M de la vanilline = 152.2g/mol
m est la masse de vanilline dans la solution mère F0 de volume V0=1L, la solution mère F0 contient aussi 4g d'hydroxyde de sodium. m=100mg
On prépare aussi un litre d'une solution S0 d'hydroxyde de sodium (4g/L d'hydroxyde de sodium)
On prépare dans une fiole jaugée V1=100mL une solution ou l'on introduit V2=1mL de F0 et on ajoute S0 jusqu'au trait de jauge soit 99mL. On nomme cette solution F1 (solution fille)
On donne aussi les incertitudes absolues sur les mesures effectuées :
Fiole jaugée de 1L : Incertitude absolu 0.4mL
Fiole jaugée de 100mL : Incertitude absolu0.1mL
Pipette jaugée de 1mL : Incertitude absolu 0.007mL
Balance de précision : Incertitude absolu de 0.1mg
On dit aussi que l'incertitude relative sur C1 est la somme des incertitudes relatives sur m, V0, V1 et V2
Soit
C1/C1=V0/V0+V1/V1+V2/V2+m/m
Je suis perdu, il y a trop de valeurs, je ne sais pas lesquelles utiliser, faut-il utiliser Cm0xVo=Cm1xV1 ?
merci de votre aide.
Bonsoir jackychan : Le développement de ton problème est incompréhensible ! c'est quoi FO et SO ? je comprends que tu sois perdu ? Explique d'une façon plus claire
ce que tu cherche . Tu parles d'incertitude absolu ?? .
Bonsoir! J'ai moi aussi cet exercice à faire pour la rentrée en devoir maison!
F0 est le nom donné à la solution mère (F1 étant le nom de la solution fille)
Quant à S0, c'est le nom de la solution d'hydroxyde de sodium.
En fait le "0", est en indice dans F0 et S0.
Voili, voilou.
Bonsoir cherie-currie : Pourrais-tu m'expliquer clairement ce problème ! C'est quoi V0, V1, V2, et l'incertitude absolu et incertitudes relatives ? si tu n'a pas plus
de transparence , je ne peux pas t'aider !.
Dans cet exercice, nous avons un document. Une protocole d'une expérience:
Dans une fiole jaugée de V0=1,000L, préparer une solution mère F0 contenant m=100,0mg (soit 0,6579 mmol) de vanilline et 4,0g d'hydroxyde de sodium (sa concentration est de 0,1 mol/L, soit 4g d'hydroxyde de sodium par litre d'eau).
Dans une fiole jaugée de volume V1=100,0 mL, introduire à la pipette jaugée V2= 1,00 mL de FO et ajouter SO jusqu'au trait de jauge. F1 est cette solution fille.
Préparer de même les solutions F2 à F6 en diluant, dans des fioles de 100mL, les volumes V=2,00 ; 3,00 ; 4,00 ; 5,00 et 6,00mL de F0 avec S0.
Mesurer l'absorbance A de ces différentes solutions à 348nm et tracer la droite d'étalonnage A=f(c)
La question à laquelle nous sommes coincé, est la suivante:
Donner l'expression de la concentration molaire c1 en vanilline de la solution F1 en fonction de m, V0, V1, V2 et de la masse molaire M de la vanilline (M=152,2 g/mol).
Les incertitudes absolues sur les mesures effectuées sont les suivantes:
Matériel / Incertitude absolue sur la mesure
- Fiole jaugée de 1,00L / 0,4 mL
- Fiole jaugée de 100 mL / 0,1 mL
- Pipette jaugée de 1,00 mL / 0,007 mL
- Balance de précision / 0,1 mg
L'incertitude relative sur c1 est la somme des incertitudes relatives sur m, V0, V1, et V2:
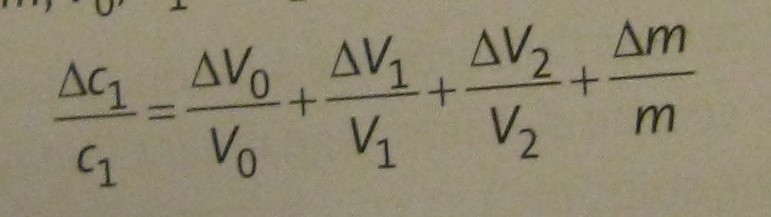
Bonjour Cherie-Currie : Vaniline masse moléculaire = 152
Solution mère VO de 1000 ml contenant 100 mg ( 0,6579 mmol de vaniline et 4 g de NaOH ( 0,1 mol ) = Concentration molaire/L en vaniline = 0,0006579 molaire .
Solution fille F1/V1 de 100 ml contenant 1 ml de solution mère ( soit 0,1 mg de vaniline ) = concentration C1 = 0,1 mg/100 ml ( 0,000657 mmol ) ou encore 1 mg/1000 ml .
Concentration F2/2ml = 0,2 mg de vaniline = concentration C2 = 0,2 mg/100 ml ( 0,001314 mmol ) ou encore 2 mg/1000 ml .
Concentration F3/3ml = 0,3 mg de vaniline = concentration C3 = 0,3 mg/100 ml ( 0,001974 mmol ) ou encore 3 mg/1000 ml.
Concentration F4/4ml = 0,4 mg de vaniline = concentration C4 = 0,4 mg/100 ml ( 0,002631 mmol ) ou encore 4 mg/1000 ml
Concentration F5/5ml = 0,5 mg de vaniline = concentration C5 = 0,5 mg/100 ml ( 0,003289 mmol ) ou encore 5 mg/1000 ml
Concentration F6/6ml = 0,6 mg de vaniline = concentration C6 = 0,6 mg/100 ml ( 0,003947 mmol ) ou encore 6 mg/1000 ml
Voilà j'espère t'avoir répondu comme j'ai compris les questions ? Bonnes salutations .
Tu as utilisé la formule:
C = n / V
c'est ça ?
avec C, la concentration en mol/L
n, la quantité de matière en mol
et V, le volume de la solution en L
Je ne comprends pas tout car la question me demande d'exprimer c1 en fonction de m, V0, V1, V2 et M. Pour trouver c1, tu ne t'es pas servi de V2, si ?
J'ai également cet exercice à faire pour la rentrée et par intuition je pense avoir trouvé que C1=O,65.10-5 mais j'ai vraiment un problème avec l'expression littérale en fonction de m, VO, V1, V2 et M ...
Si vous pouviez nous aidez le plus vite possible s'il vous plaît, ça nous bloque pour le reste de l'exercice =/ (du moins en ce qui me concerne)
Merci.
J'ai tenté de trouver c1 grâce au tableau donné après à l'aide de A = k . C
Mais ce n'est pas ce qu'il faut faire...
C'est ce que tu as fait, par intuition également elev ?
Oui c'est ça Cherie-Currie mais ça ne m'avance pas plus que ça étant donné que je n'ai pas l'expression littérale... Je l'avais aussi trouvé en faisant C1= m/(M*V0), mais l'expression littérale n'est pas bonne puisqu'il me manque des données (V1 et V2) donc est-ce une coïcidence ?
Je suis perdue aussi, je ne vois vraiment pas comment utiliser toutes les données : v0, v1, v2 etc..
J'ai tenté pleins de calculs sans succès..
Et ça bloque vraiment pour la suite de l'exercice.


