Inscription / Connexion Nouveau Sujet
Exercice sur l'oxydo-réduction
Bonjour a tous, je suis actuellement des cours par correspondance pour passer un bac STAV et étant assez mauvaise en physique-chimie, j'aurais besoin de votre aide pour un exercice sur l'oxydo-réduction. Voici l'énoncé:
Dire si les systèmes suivants donneront lieu a une réaction spontanée ou non, dans le cas d'une réaction, écrire l'équation bilan.
A) Ag / Al3+(ag)
B) Cu2+(ag) / Al
C) Cu / Zn2+(ag)
D) Zn / Cu2+(ag)
E) Al3+(ag) / Cu
Merci d'avance de votre aide =)
tu as écrit (ag) à la place de (aq)
Al3+(aq) signifie ions Al3+ en solution aqueuse.
Dans cet exercice Ag/Al3+ (aq) signifie que l'on plonge un morceau en argent (métal)dans une solution de Al3+
Attention !Ici,La barre (/) peut prêter à confusion.Il ne s'agit pas d'un couple redox
Les espèces en présence sont donc Al3+(aq) et Ag
Pour savoir s'il y a réaction (sans faire l'expérience !) ,il faut :
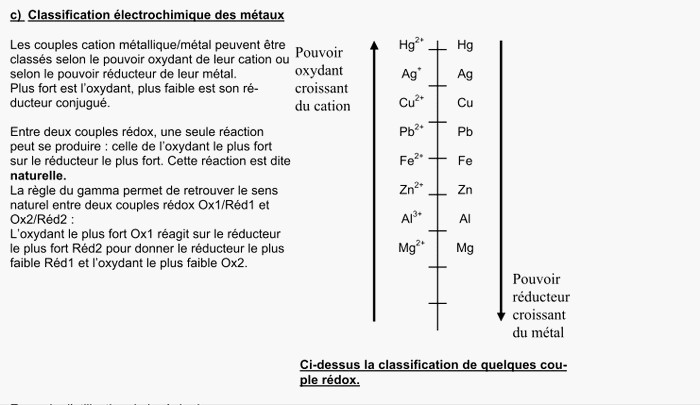
identifier les couples redox intervenant (voir un livre)
ici ,les couples sont Al3+(aq)/Al et Ag+/Ag
Utiliser une classification des couples redox (livre ou autre document)
on procède ainsi
1) on écrit les deux couples concernés en respectant leur ordre
2)on souligne les espèces présentes (ici Al3+ et Ag)
3)si l'oxydant présent est plus haut que le réducteur présent ,la réaction est possible (on peut tracer la lettre "gamma" en partant de l'oxydant)
Dans le cas contraire ,la réaction(spontanée) est impossible.
Application à ce cas
le classement est
Ag+(aq) / Ag
Al3+(aq) / Al
on voit que l'oxydant (Al3+) est plus bas que le réducteur (Ag)
Il n' y a pas réaction
cas B) on trempe une lame d'aluminium dans une solution de Cu2+
les couples qui interviennent sont Cu2+(aq)/Cu et Al3+(aq)/Al
classement
Cu2+ /Cu
Al3+(aq)/Al
dans ce cas,l'oxydant (Cu2+) est au-dessus du réducteur (Al)
Il y a donc réaction
(il serait plus correct d'écrire :le couple auquel appartient l'oxydant présent est au dessus du couple auquel appartient le réducteur présent)
On écrit les 1/2 réactions d'oxydation et de réduction
Cu2+ +2e = Cu
Al =Al3+ + 3e
Comme le nombre d'électrons gagnés par l'oxydant doit être égal au nombre d'électrons perdu par le réducteur,on choisit le plus petit multiple commun (ici 6e)
on a donc
3Cu2+ +6e =3Cu
2Al =2 Al3+ +6e
en additionnant les 2 1/2 réactions ,les électrons disparaissent le l'équation bilan
3 Cu2+ + 2 Al = 3 Cu +2 Al3+
Tu dois pouvoir faire les autres exercices