Inscription / Connexion Nouveau Sujet
etude d'une eau minérale naturelle (type bac) 1ereS
Bonjour à tous j'aurais besoin d'aide s'il vous plait pour mon devoir maison
j'ai trouvé d'autres devoirs maison de ce genre mais aucun de répondait aux questions que je me pose .
Enoncé :
L'étiquette d'une bouteille d'eau minérale donne de très nombreux renseignements sur la composition de l'eau. Nous lisons, entre autres :
Caractéristiques chimiques, en mg/L :
Calcium Ca²+ : 78
Sodium Na+ : 5
Sulfate SO4 ²- : 10
Chlorure Cl- : 4.5
Magnésium Mg2+ : 24
Potassium k+ : 1
Bicarbonate HCO3- : 357
Nitrate NO3- : 3.8
Résidu sec, à 180°C : 309 mg/L ; pH : 7.2 à 25°C
D'autres paramètres, comme la conductivité, sont par ailleurs controlés quotidiennement. Pour cette eau minérale : à 20°C,  =521
=521 S/cm et, à 25°C,
S/cm et, à 25°C,  =578
=578 S/cm
S/cm
Questions :
1.Quel renseignement fournit la valeur du pH ?
2.Le résidu sec correspond principalement aux solutés solides présents après évaporation de toute l'eau.
En faisant un tableau à double entrée, une pour les anions et une pour les cations, donner la formule de tous les solutés susceptibles de se trouver dans les résidus secs.
3.Pourquoi indique t-on la température à laquelle la conductivité a été déterminée ? Justifier la différence observée à 20°C et à 25°c.
4.On souhaite vérifier la valeur de la conductivité en faisant au laboratoire une mesure de conductance avec une cellule conductimétrique de constance k=s/l
a.Dans une premier temps, on détermine k avec une solution de chlorure de potassium étalon dont la conductivité à 25°C vaut :  =1.260 S.m-1 , la mesure de sa conductance donne : G=15.48 mS. En déduire k.
=1.260 S.m-1 , la mesure de sa conductance donne : G=15.48 mS. En déduire k.
b.Quelles doivent etre les conductances de l'eau minérales avec le meme montage, à 20°C et à 25°C, si les valeurs indiquées sur l'étiquette sont correctes ?
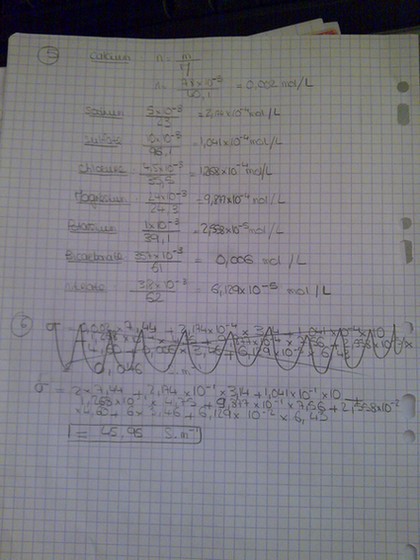
5.Calculer la concentration molaire de tous les ions présents dans l'eau.
6.En admettant que la conductivité de la solution est :  =
=
 i . [Xi]=
i . [Xi]= Ca2+ . [Ca²+] +
Ca2+ . [Ca²+] +  Cl- . [Cl-] + ...
Cl- . [Cl-] + ...
déterminer la conductivité de la solution.
Données : à 20 °C en mS.m².mol-1
 So42- = 10
So42- = 10
 Cl- = 4.75
Cl- = 4.75
 k+ = 4.60
k+ = 4.60
 Ca2+ = 7.44
Ca2+ = 7.44
 Na+ = 3.13
Na+ = 3.13
 HCO3- = 3.46
HCO3- = 3.46
 Mg2+ = 7.56
Mg2+ = 7.56
 NO3- = 6.43
NO3- = 6.43
Masses molaires en g.mol-1
MS=32.1
MO=16.0
MH=1.0
MC=12.0
MCa=40.1
MCl=35.5
MMg=24.3
MNa=23.0
MK=39.1
MN=14.0
J'écrirais mes réponses lundi, mardi ou mercredi !
Merci à vous
![]() type bac, étude d'une eau minérale
type bac, étude d'une eau minérale
explication pour les questions 1 et 2 ( meme exercice)
1. pH=7.2 donc c'est une eau quasiment neutre
3.la température fait varier la conductivité d'une solution.En effet, plus la solution est "chaude" et plus les ions sont mobiles.Donc à 25°C la condutivité est plus importante qu'a 20°C.
4.a. k=G/
k=15.48/1.260
=12.29*10^-3
.b. G=k*
à 20°c G=12.29*10^-3*521*10^-3
=6 mS
à 25°C G=12.29*10^-3*578*10^-3
=7 mS
pour la question 5, c'est la formule C=n/V mais j'additionne toutes les mol des ions et je divise par combien car ce n'est pas précisé...??

3) la température est effectivement une notion faisant varier la conductivité , car plus la température est élevé ( du à une augmentation de la pression , voire agitation des molécules) , plus la conductivité est importante.
4) a) oui n'oublie pas l'unité
b) oui
5) 1 L soit la contenance de la bouteille d'eau minérale car mg/L
ouais tu as raison car C = n puisque V = 1
sauf
Données : à 20 °C en mS.m².mol-1
bonjour où es la réponse à la question N°2 ?
Merci j'en ai absolument besoin car je n'y arrive pas :/
Bonsoir!
J'ai cet exercice dans un devoir maison a rendre lundi, j'ai bien étudié les explications et les réponses données ici, seulement je ne comprend pas cette réponse-ci
4.a. k=G/
k=15.48/1.260
=12.29*10^-3
D'où vient le *10^-3?
Il y a certainement une explication avec l'unité, mais je ne sais pas en quoi tout doit être exprimé, ayant été absent lors des explications en cours..
Merci d'avance =)
Ah D'accord, ce qui donne G = 15.48^10-3
Je comprend mieux, le calcul en haut me semblait confus..
Merci a toi Kaela =)
Bonjour,
Sur la photocopie que tu laisse présentant les concentrations des différents ions présents, pourquoi trouves-tu, pour le Calcium, 2.0 x 10-3 mol.L-1??
En tapant 7.8 x 10-3 / 40.1, je trouve 1.9x 10-4
L'attitude de l'élève addict de la calculatrice et qui en oublie de vérifier auparavant ses chiffres ou de faire une vague estimation via le calcul mental.
Mais c'est la faute de la calculatrice , elle ne s'est pas comptée !!
Ce n'est pas un taunt , juste un constat navrant ! Mais pas de calculatrice au bac , ça fait du bien uhuh !