Inscription / Connexion Nouveau Sujet
Esterification
Bonjour tout le monde, je suis actuellement en train de faire un sujet portant sur l'estérification. Cependant, j'éprouve de la difficulté pour la partie 2 de mon exercice, plus précisément à partir de la question 4 où j'ai l'impression qu'il y a une confusion... J'expliquerai plus en détail mon questionnement juste après avoir présenté l'énoncé.
Enoncé
L'éthanoate de butyle ou parfum de pomme a pour formule brute : C6H1202
I - Etude quantitative de l'équation de la réaction
Je n'ai vraiment pas éprouvé de difficultés pour cette partie.
La dernière question était de donner le nom de la réaction entre un acide carboxylique (A) qui est ici un acide éthanoïque et un alcool primaire (B), ici du butan-1-ol. J'ai écrit que c'était une estérification.
On a : A + B = C + eau
A : CH3COOH
B : C4H10O
C : C6H12O2
II - Caractéristiques de la réaction
Pour préparer cet arôme, on introduit 36,0g de A, 44,4g de B et 2,0 mL d'acide sulfurique concentré. On chauffe à reflux pendant une heure, on refroidit le mélange réactionnel. Après un temps t1, on prélève un échantillon du mélange réactionnel que l'on dose avec de l'hydroxyde de sodium. On trouve 0,4 mol d'acide carboxylique A.
Mon problème ici c'est que l'on parle d'un dosage entre un ester et de l'hydroxyde de sodium, et pourtant, on obtient de l'acide carboxylique et non un ion carboxylate qui serait ici un ion éthanoate. C'est ce que je ne comprends pas. Dans la suite de l'exercice, on nous demandera de dresser un tableau d'avancement, puis de calculer son rendement sauf que je ne sais pas comment c'est possible d'obtenir de l'acide carboxylique. J'ai supposé que le mélange réactionnel contenait de l'eau et donc cela expliquerait la formation d'un acide carboxylique sauf que le problème, c'est qu'on dose un échantillon du mélange, avec de l'hydroxyde de sodium... Je suis perdue (Est-ce une erreur dans le sujet ?) :/
Questions
1. Nommer les espèces chimiques présentes dans le mélange réactionnel.
- acide éthanoïque (A)
- butan-1-ol (B)
- acide sulfurique
2. Justifier l'intérêt de la présence de l'acide sulfurique
L'acide sulfurique est un catalyseur, il permet d'accélérer la vitesse de la transformation chimique.
3. Montrer que le mélange initial est équimolaire
- n(A) = m(A)/M(A) = 36,0/60 = 0,6 mol (La quantité de matière est fournie dans les données de l'exercice)
- n(B) = m(B)/M(B) = 44,4/74 = 0,6 mol
Le mélange est bien équimolaire n(A)=n(B).
4.(aka la question qui fache) Dresser le tableau d'avancement correspondant à cette réaction chimique
Et bien là, je ne sais pas quoi faire... J'ai même essayé en mettant 3 réactifs : l'ester, l'eau et l'hydroxyde de sodium mais ça ne colle pas avec les produits... Donc voilà... Je vous remercie d'avance pour toute réponse apportée ! 
Bonne journée à vous !
Bonsoir
Je pense que tu fais une confusion entre deux réactions :
1 La réaction d'esterification que l'on doit étudier ici et pour laquelle il faut remplir un tableau d'avancement.
2 La réaction de titrage de l'acide carboxylique n'ayant pas réagit par estérification. Cette réaction de dosage se fait par action de la soude sur l'acide carboxylique n'ayant pas réagit par estérification.
Merci beaucoup pour votre réponse ! Donc si je comprends bien, je dois faire un tableau d'avancement par rapport à la réaction A + B = C + eau. Concernant la question 5 : Déterminer le rendement de la réaction à l'instant t = t1, je pense ne pas avoir bien compris. Je dois écrire une réaction comme : CH3COOH + HO- = CH3COO- + H2O ?
De là, il faudrait que je calcule la quantité de matière d'acide carboxylique à l'état maximale cependant, je n'ai pas d'information me permettant de calculer la quantité de matière de l'hydroxyde de sodium. Je ne dispose que des masses molaires des éléments, je n'ai pas la masse en hydroxyde de sodium apportée.
La réaction de dosage avec la soude est juste indiquée pour faire comprendre comment on peut savoir qu'à la date t1, le mélange contient O,4mol d'acide carboxylique sachant qu'il en a été introduit 0,6mol. Pour le reste, il faut se concentrer sur l'étude de la réaction d'estérification en oubliant cette réaction de dosage qui te perturbe tant ! Imagine un énoncé plus simple qui ne parlerait pas de ce dosage par la soude mais qui préciserait juste :
"Une méthode de mesure non étudiée ici permet de savoir que, à la date t1, la quantité restante d'acide vaut 0,4mol."
Toutes les questions posées concernent la réaction d'estérification.
D'accord je vois ! Cependant, pour la question sur le rendement je crois que je m'emmêle les pinceaux avec les xf et xmax. Pour moi, à t1, on a donc 0,4 mol d'acide carboxylique, et donc si on fait la réaction avec l'alcool, on aura une quantité d'ester égal à 0,4 mol. Et donc il faudrait faire xf/xmax = n(ester)experimental/n(ester)maximale = 0,4/0,6 = 0,67. On a donc un rendement cohérent avec la question qui suit mais je ne suis pas sûr que c'était la bonne manière de penser. Surtout que si xf < xmax, on devrait avoir encore tous les réactifs dans le bécher, sauf que l'acide carboxylique devient limitant, donc je trouve ça bizarre...
Questions
6. Pour des réactifs introduits en quantités équimolaires, le rendement est de 67% avec un alcool primaire, de 60% avec alcool secondaire et de seulement 5% si l'alcool est tertiaire. En utilisant le résultat du rendement de la question 5, dire si la réaction du mélange étudié a atteint l'équilibre ou pas. Justifier votre réponse.
Ici, je vois que ça tombe bien, j'ai le bon rendement, cependant je ne sais pas comment prouvé qu'on est à l'équilibre ou non. Dans l'énoncé on nous dit que K = 4 mais je ne pense pas qu'il faut utiliser ça pour répondre à la question.
7. Ecrire l'expression littérale de la constante d'équilibre K correspondante.
Je suppose que c'est : K = n(ester) x n(eau) / n(acide) x n(alcool) Cependant, si je fais ce calcul avec mes données, je n'obtient pas 4. Est-ce normal ? Mon calcul ce serait : 0,4x0,4/0,4x0,6
Donner une définition simple de l'équilibre
C'est lorsque la vitesse de réaction dans le sens directe est égale à la vitesse de réaction dans le sens indirecte. Il n'y a donc pas de changement au niveau macroscopique.
(Dernière question) Déterminer la valeur de l'avancement final xf à l'équilibre. La valeur est-elle cohérente avec le résultat de la question 6?
Donc ici, je suis un peu perdue, pour moi on a déjà xf qui serait égal à 4... Mais peut être que je ne différencie pas xf de xf à l'équilibre... Je sais pas trop
Le quotient de réaction est :
L'équilibre est atteint si Qr=K , ce qui est le cas ici. En effet, tu as commis une erreur dans ton tableau d'avancement.
L'avancement maximum est la valeur de l'avancement en supposant la réaction totale. C'est donc l'avancement correspondant à une quantité restante nulle du ou des réactif(s) limitant(s).
L'avancement final n'est égal à l'avancement maximum que si la réaction est totale. Le rapport xf/xm est le rendement.
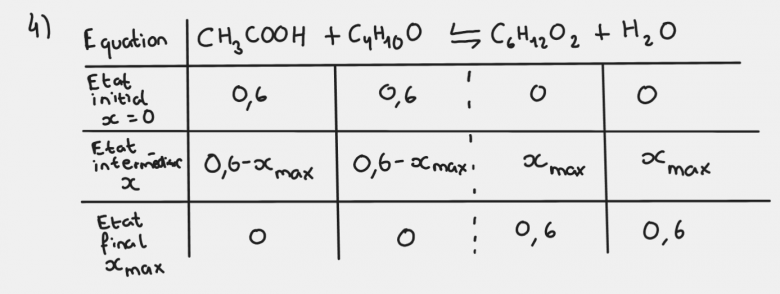
Voici une photo de mon tableau d'avancement pour la question 4. Pour la question 5, j'ai supposé que l'acide valait 0,4 mol et j'ai donc pu avoir une quantité d'ester "finale" si j'ai bien compris à 0,4 mol ce qui m'a permis de trouver un rendement de 67% : 0,4/0,6.
Mon problème c'est que je ne sais pas comment prouver que cette réaction est à l'équilibre. Vous me dites qu'il y a une erreur dans mon tableau d'avancement mais parlez-vous de celui de la question 4 ou celui qu'on aurait pu faire à la 5 ? ou même à la 6? Je n'arrive pas à trouver Qr = 4. Donc il y a surement une erreur mais je n'arrive vraiment pas à la dénicher.
D'accord, donc pour la question 5, on répond qu'on a bien un état d'équilibre et que xf = 0,4 mol ? Cependant, je n'arrive toujours pas à prouver que Qr = 4 avec mes quantités de matières...
D'accord je vois. Mais du coup, mon tableau d'avancement pour la question 4 est il bien correcte ?
Aussi, pour la question 5, je ne sais pas comment justifier qu'on a bien atteint l'équilibre. (Enfin, si parqu'il reste à la fin de la réactions tous les réactifs), mais si je comprends bien, dans n'importe quelle réaction on atteint un état d'équilibre si cela correspond à l'état final non ? Donc je comprends pas pourquoi la question. On pourrait ne pas atteindre l'équilibre ? C'est lorsque la réaction est totale qu'on atteint pas l'équilibre comme un réactif est totalement consommé ?
Ce que je comprends pas c'est que avec 0,4 mol d'acide on aurait l'acide qui deviendrait limitant, non ? Pourquoi ne l'est-il pas ici ? Pourquoi on a 0,2 mol ? J'ai compris qu'on faisait 0,6-0,4 mais pourquoi on ne fait pas 0,4-0,4 ? Comme l'avancement x correspond à 0,4 et que c'est aussi la quantité d'acide. Je ne sais pas comment xf a pu être trouvé sans qu'on fasse 0,4-x pour l'acide en disant que l'acide est limitant.
Enfaite, je ne comprends pas pourquoi on fait 0,6-0,4 pour chaque réactif alors que la quantité d'acide est maintenant de 0,4. Je ne comprends pas bien ce nouveau tableau.
Je reprends le tableau d'avancement car j'ai effectivement commis une étourderie dans mon dernier message.
| Espèces chimiques | Acide | Alcool | Ester | Eau |
| Quantités introduites (mol) | 0,6 | 0,6 | 0 | 0 |
| Quantités à la date t1 (mol) | 0,6-x1=0,4 | 0,6-x1=0,4 | x1=0,2 | x1=0,2 |
| Quantités limites (réaction totale) (mol) | 0,6-xm=0 | 0,6-xm=0 | xm=0,6 | xm=0,6 |
Ainsi à la date t1 :
A la date t1 : Qr < K ; l'équilibre n'est pas encore atteint car la réaction est extrêmement lente. Le rendement à la date t1 vaut :


