Inscription / Connexion Nouveau Sujet
Dosage ph métrique
Bonjour, je dois terminer mon projet de TSTL et je suis bloqué à un endroit.
J'ai réalisé un dosage de l'acide phosphorique pour connaître sa concentration dans le coca
Sa quantité en mol/L
J'ai, par exemple, dosé 20ml de coca normal avec une solution de soude à 0.02 mol/L et j'ai un volume équivalent de 4.24 mL
J'ai effectué le calcule suivant :
C(H3PO4)= C(NaOH) x Veq / Vdose
= 0.02 x 4.24*10^-3 / 0.02
=4.24*10^-3 mol/L
Est ce que cela vous semble bon ?
Bonjour
L'acide phosphorique est un triacide. Son dosage par la soude fait apparaître deux sauts de pH comme le montre la courbe ci-dessous ; on peut donc définir deux volumes équivalents, le second étant le double du premier. Sans expliquer comment tu as repéré le volume équivalent, impossible de te répondre.
Si tu as utilisé un indicateur coloré, précise lequel...
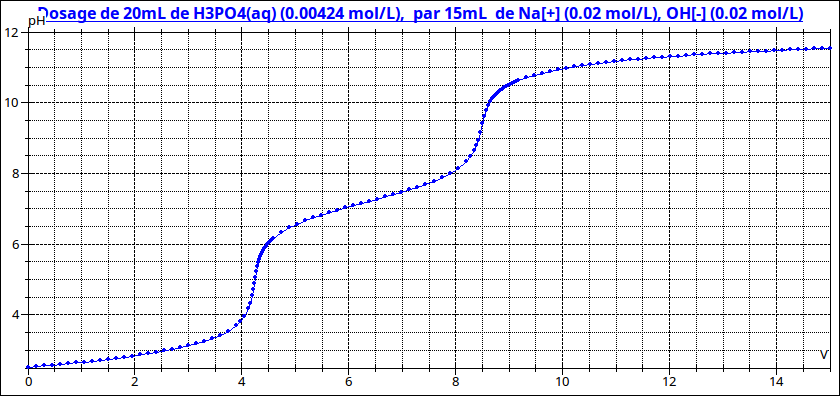
Je l'ai repéré par une aussi, je l'ai faite sur régressi
Il m'a indiqué le premier saut à 4.24 mL
J'aimerai juste savoir si mon résultat semble bon ou non pour déterminer la concentration H3PO4 dans les 20ml de coca dosé
Merci



