Inscription / Connexion Nouveau Sujet
Dosage des ions chlorure dans un lait
Bonsoir, j'aurais besoin d'aide pour cet exercice. J'ai déjà fait les question 1, 2 et 3. J'ai des difficultés pour comprendre la 4.
Merci de votre aide.
Dosage des ions chlorure dans le lait
Une inflammation des mamelles des vaches rend le lait impropre à la consommation. Or cette inflammation se traduit par une augmentation de la concentration en ions sodium Na+ (aq) et chlorure Cl - (aq).
Une mesure de la conductivité du lait, après la traite, permet de déterminer sa concentration en ions chlorure Cl - (aq) et donc de vérifier s'il est consommable.
Pour réaliser ce titrage, un lait frais est dilué 5 fois. Soit S1 la solution de lait diluée et C1 sa concentration en ions chlorure.
On verse un volume V1 = 10,0 mL de solution S1 dans un bécher et on ajoute environ 250 mL d'eau distillée.
On mélange, puis on plonge dans le bécher une cellule conductimétrique.
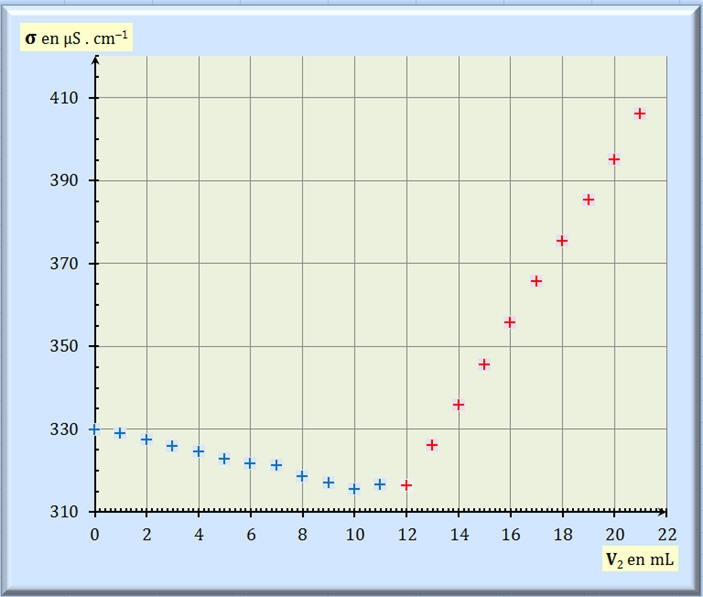
Initialement et après chaque ajout millilitre par millilitre d'une solution S2 de nitrate d'argent {Ag+ (aq) + NO3- (aq)}, de concentration C2 = 5,00 x 10-3 mol . L-1, on mesure la valeur de la conductivité σ de la solution et on obtient la courbe suivante :
La réaction, rapide, met uniquement en jeu les ions chlorure et les ions argent selon l'équation :
Ag+ (aq) + Cl- (aq) → AgCl (s)
1. Pourquoi la conductivité initiale de la solution S1 n'est-elle pas nulle ?
2. Pourquoi ajoute-t-on un volume d'environ 250 mL d'eau distillée dans le bécher ?
3. Déterminer graphiquement le volume VE de solution de nitrate d'argent versé à l'équivalence.
4.
a. Montrer que la conductivité dans le bécher, en un point du titrage avant l'équivalence, s'écrit : (voir image jointe)
- Où σ0 est la conductivité de tous les ions spectateurs initialement présents dans le lait et Vtot est le volume de la solution dans le bécher.
b. Justifier la diminution de la conductivité σ du milieu réactionnel avant l'équivalence.
5. Établir l'expression de la conductivité dans le bécher après l'équivalence, et justifier son évolution.
6. Déterminer la concentration molaire C1 en ions chlorure initialement présents dans la solution S1, puis la concentration C0 en ions chlorure du lait.
7. Dans le lait frais analysé, la concentration massique moyenne en ions chlorure se situe entre 0,8 g . L-1 et 1,2 g . L-1. Le lait analysé est-il consommable ?
- Données :
- λ1 = λ (Cl-) = 76,3 x 10-4 m2 . S . mol-1
- λ2 = λ (NO3-) = 71,4 x 10-4 m2 . S . mol-1
- λ3 = λ (Ag+) = 61,9 x 10-4 m2 . S . mol-1
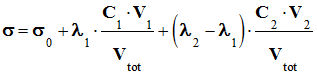

 !
!

