Inscription / Connexion Nouveau Sujet
dosage d'un produit ménager
bonjour, j'aurais besoin d'aide pour cet exo, merci.
On trouve dans le commerce des produits liquides servant à déboucher les canalisations obstruées. On peut lire sur l'étiquette " danger, produit corrosif; contient de l'hydroxyde de sodium( soude caustique) solution à 20%". On se propose de vérifier cette teneur en soude par dosage avec une solution connue d'acide chlorhydrique.
préparation d'une solution diluée :
Le produit commercial est trop concentré pour pouvoir être dosé directement. On prépare donc 500 mL d'une solution diluée 50 fois (solution S).
1)a)Indiquer le volume de solution commerciale à prélever pour réaliser cette dilution.
b)Indiquer le matériel nécessaire. Préciser les précautions à prendre pur opérer en sécurité.
dosage pH-métrique :
On souhaite doser 20 mL de la solution diluée avec une solution d'acide chlorhydrique de concentration Ca = 0,1 mol.L-1, en utilisant un pH-mètre.
2)a)Faire un schéma annoté du montage.
Avant de commencer le dosage, on ajoute un peu d'eau dans le récipient contenant S.
b) Donner la raison de cet ajout d'eau. Indiquer si cet ajout d'eau a une influence sur le résultat du dosage.
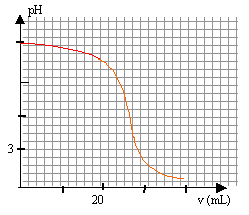
Les mesures ont permis d'obtenir la courbe suivante (voir plus bas).
c)Ecrire l'équation de la réaction qui se produit lors de ce dosage. Préciser ses caractéristiques.
d)définir équivalence acido-basique.
e)déterminer le volume équivalent en précisant votre méthode.
f)en déduire la concentration Cs de la solution diluée, puis la concentration C de la solution commerciale.
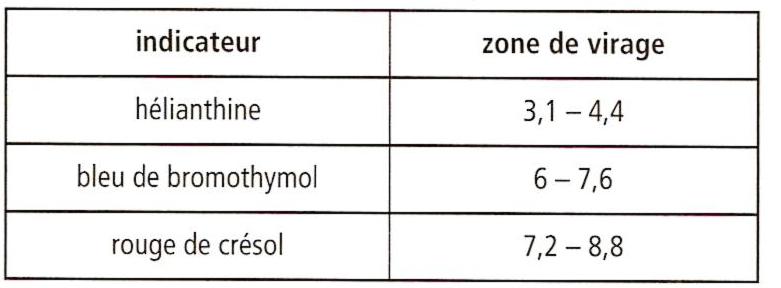
g)Pour réaliser un dosage plus rapide, on aurait pu effectuer un dosage colorimétrique. Préciser le meilleur indicateur coloré à choisir parmi ceux indiqués.
h)Déduire du résultat précédent le pourcentage en masse d'hydroxyde de sodium contenu dans le déboucheur. Masse volumique du liquide déboucheur : 1,208 kg /L.
i)Calculer l'écart relatif, en pourcentage, par rapport à la valeur indiquée par le fabricant.
Masse atomique (g/mol) : H=1 ; O=16 ; C=12 ; Na=23.
bonjour.
b) on utilise une fiole jaugée de 500 ml, une pipette jaugée de 10 ml + un pipeteur. il faut se munir de gants et de lunette de protection car la solution est corrosive
Je confirme 
Un petit détail à corriger néanmoins : le symbole utilisé pour les millilitres est mL avec un L majuscule.
ok.
2)a) schéma ok, normalement.
b)l'ajout d'eau permet d'immerger correctement la sonde du pH mètre. cet ajout d'eau n'a aucune influence car l'eau n'apporte quasiment pas d'ion hydroxyde
L'ajout d'eau revient à faire une dilution. Or la quantité de soluté est inchangée par dilution, donc la quantité de matière dosée sera la même. Néanmoins, par la suite on te demande la concentration de la soude donc il faudra bien divisé par le volume de la solution. L'ajout d'eau aura donc une influence mais elle sera négligeable si le volume d'eau ajouté est très inférieur au volume de la solution.
Il faut que tu te demandes quelles espèces sont présentes et lesquelles sont susceptibles de réagir.
Dans la solution, tu as de la soude donc des ions sodium et des ions hydroxyde.
Dans la burette graduée, tu as de l'acide chlorhydrique donc des ions chlorure et des ions oxonium.
Or les ions hydroxyde et oxonium sont connus pour réagir selon une réaction acido-basique totale : c'est parfait pour un dosage.
L'équation de la réaction de dosage est donc . Cette une réaction que tu as dû rencontrer fréquemment ces deux dernières année en chimie.
Il s'agit des couples et
.
Tu as dû étudié cette réaction en détail dans le chapitre sur l'autoprotolyse de l'eau (qui peut réagir à la fois comme une base et comme un acide).
ah ok. donc cette réaction est à savoir par coeur parce qu'on ne peut pas deviner que ces ions sont spectateurs
En effet, il s'agit d'une question de culture. C'est une réaction que tu as dû rencontrer plus d'une fois : elle se retrouve dans de nombreux exercices et sujets de BAC.
Tu comprendras plus tard comment on peut prévoir que telle ou telle réaction va se faire préférentiellement à une autre (en gros, on compare les pKa des différents couples présents).
Vu comme la question est formulée, tu peux écrire directement l'équation de la réaction (comme on disait : question de culture).
S'il était attendu que tu donnes les couples acido-basiques à considérer et/ou les demi-équations correspondantes, on te l'aurait explicitement demandé.
ok.
d) à l'équivalence acido basique, les quantités de réactifs sont dans les proportions stoechiométrique ?
Oui mais connaissant les réactifs titrant et titrée, tu peux même être plus précis.
À l'équivalence, on a introduit juste assez de réactif titrant (ions oxonium) pour consommer tout le réactif titré (ions hydroxyde).
Ou alors en utilisant ta définition : à l'équivalence, les ions oxonium et hydroxyde sont dans les proportions stchiométriques.
En effet, il s'agit de la définition de l'équivalence.
C'est pourquoi je préfère "ma" définition : c'est plus clair.
Les deux principales méthodes sont la méthode des tangentes et la méthode de la dérivée. Or, ici, tu ne disposes pas de la courbe de la dérivée donc, en effet, appliques la méthode des tangentes.
Sur la courbe du pH en fonction du volume, tu as un premier arrondi puis une brusque diminution de pH puis un second arrondi.
La première tangente à tracer est la tangente au premier arrondi. La seconde est la tangente au second arrondi sachant qu'elle doit être parallèle à l'autre tangente.
Ensuite tu traces une droite perpendiculaire à ces deux tangentes, tu repères le milieu puis tu traces une droite parallèle aux deux tangentes passant par ce milieu. L'abscisse de point te donne la valeur du volume équivalent.
il demande notre méthode pour déterminer VE. Je dis juste que j'ai utilisé la méthode des tangentes ?
Oui.
Si la courbe est sur une feuille que tu vas rendre avec (ce qui est peut être le cas au BAC ou en DS), il faut également faire apparaître les traits de construction.
Si c'est un exercice du livre, tu ne peux pas montrer les traits de construction donc indique simplement que tu as utilisé la méthode des tangentes.
Tu connais l'équation de la réaction de dosage.
Tu peux donc faire un tableau d'avancement : une ligne pour l'état initial et une ligne pour l'équivalence.
Tu pourras donc en déduire une relation entre les quantités de matières des espèces titrante et titrée.
Tu n'arrives pas à faire de tableau d'avancement ?!
Au départ, on a une quantité de matière d'ions hydroxyde. À l'équivalence, on apporte une quantité de matière
d'ions oxonium.
Or, à l'équivalence, on a apporte juste assez de réactif titrant (ions oxonium) pour consommer tout le réactif titré (ions hydroxyde). Donc, d'après la stchiométrie de la réaction de dosage, on a et
d'où
puis
.
On a dilué la solution 50 fois, donc .
Je te laisse faire les applications numériques 
Non, il faut le justifier : là c'est facile parce que les coefficients des réactifs titrant et titré sont égaux à 1 mais si tu avais eu 5 et 3 tu auras fait comment ?
Soit tu fais un tableau d'avancement pour le justifier comme je te l'avais conseillé, soit tu fais des phrases comme dans mon message précédent.
je la ferait plus tard cette question.
g) VE = 25 mL en fait. pour VE = 25 mL , le pH=7,2.
le meilleur indicateur coloré est le rouge de crésol
C'est pourtant la plus importante : le raisonnement fait à cette question est capital ! Tu l'as vu pour la première l'année dernière lorsque tu as étudié l'équivalence et c'est un passage quasi-obligatoire lors d'une épreuve de chimie au BAC.
g) Il faut que la zone de virage contienne le pH à l'équivalence. J'aurais plutôt choisi le BBT.
bonjour,
calcule la masse en NaOH d'une solution à 6,25 mol/L
si  (sol)=1,208 kg/L ,1 L de solution de déboucheur à une masse de 1208g.
(sol)=1,208 kg/L ,1 L de solution de déboucheur à une masse de 1208g.
Dans 1208 g de déboucheur il y a m g de NaOH (calcul précédent).Donc ,dans 100g de déboucheur .........