Inscription / Connexion Nouveau Sujet
2.f. Oui mais respecte le nombre de chiffres significatifs.
2.g. Oui, le plus adapté est le bleu de bromothymol (dont l'abréviation est BBT !).
2.h.
pour calculer la masse on fait bien m(NaOH)=n*M mais on ne connait pas n
Bien sûr que si tu connais n ! Tu connais la concentration et le volume, tu peux donc en déduire la quantité de matière.
Le pourcentage massique d'hydroxyde de sodium vérifie
salut masterrr
je te rends la main.
Au passage ,si tu pouvais regarder le pb de Romane (chimie organique),je coince!
Bonjour coriolan 
J'ai cours cet après-midi donc je ne vais pas avoir le temps de jeter un oeil à l'exercice de -Romane-...
Peut-être plus tard si vous bloquez toujours.
Bonne journée 
Regarde mon message de 12:21.
Il y a la réponse sous forme littérale : tu n'as plus qu'à faire l'application numérique 
ok mais moi j'étais partie pour d'abord calculer la masse de soude (m=n*M)avec M=40 g.mol[sup]. après, je n'arrive pas
Dans de solution, il y a une masse
dans une masse
de solution. D'où un pourcentage massique en soude
. Résultat identique à celui établi dans mon message de 12:21, bien évidemment.
(a) Qui est m ?
(b) Quel calcul as-tu fait ? Quelles valeurs as-tu utilisées ? (parce que je ne trouve pas ça)
(c) On souhaite connaître le POURCENTAGE massique. J'ai donné la réponse dans mes messages de 12:21 et 16:35. La formule est encadrée à deux reprises et mon raisonnement a été détaillé deux fois.
à l'origine, j'étais parti pour trouver la valeur de m(NaOH).
m(NaOH)=n(NaOH) *M(NaOH)=C(NaOH)*V(NaOH)*M(NaOH)=6,25*10.10-3*40=2,5 g ?
Je préfère de loin ma méthode : pas de calculs intermédiaires !
Toi tu vas calculer la masse de soude contenue dans la solution, la masse de la solution puis le pourcentage massique donc, au total, tu vas faire trois calculs.
Alors qu'en raisonnant jusqu'au bout à l'aide de formules littérales (c'est-à-dire en gardant les lettres sans faire d'applications numériques intermédiaires), tu ne fais qu'un seul calcul ! On a dû t'apprendre qu'il faut répondre à une question sous forme littérale puis faire l'application numérique ensuite.
Mais, bon, si tu persistes dans ta lancée : ok pour ton calcul (la masse de soude dépend bien évidemment du volume de solution considéré, donc comme tu ne l'avais pas précisé je ne pouvais pas savoir ce que tu avais pris). Maintenant calcule le masse de la solution puis fait le rapport des deux. Tu obtiendras alors le pourcentage massage.
...

normalement je dois trouver m=250 g comme l'a dit coriolan
Mais non...
Coriolan a considéré un volume V=1L de solution. La masse de soude n'est pas la même. La masse trouvée dépend du volume choisi. Sauf qu'il s'agit du même volume pour le calcul de la masse de soude et pour celui de la masse de solution donc au final, peut importe le volume que tu prends : tu obtiens le même résutlat.
j'étais parti la dessus mais je vais faire ta méthode, c'était juste pour essayer de comprendre
Termine ta méthode si tu le souhaites, tu n'as plus que la masse de la solution à calculer puis à faire le rapport.
Tu pourras ensuite utiliser ma méthode et voir que tu retrouves bien le même résultat.
L'avantage de la mienne : un beau résultat sous forme littéral qui, en un seul calcul, fournit le résultat à la question

Par définition, le pourcentage massique d'hydroxyde de sodium dans la solution est le rapport entre la masse d'hydroxyde sodium et la masse de la solution : .
Peut importe le volume : il apparaît au numérateur avec la masse d'hydroxyde de sodium et au dénominateur avec la masse de la solution donc, au final, il se simplifie.
ok. quelqu'un vient de m'expliquer comment il a fait: pour 1L de solution, m(NaOH)=6,25*1*40=250 g, masse de 1L de ce produit commercial : 1208 g (je ne comprend pas ce que cela veut dire) donc pourcentage massique = 250/1208 *100 = 20,7 %
Excuse-moi de te dire ça, mais tu es en train de te perturber tout seul. Tu vas te perdre en ta méthode, celle de coriolan, la mienne et celle de ton copain (qui sont, au final, les mêmes...).
Plutôt que de vouloir comprendre quatre raisonnements à la fois, je te conseille plutôt d'en choisir un et de le comprendre LUI !
Le plus simple, rapide et compréhensible est le raisonnement que j'ai fait dans mon message de 12:21. Je pars de la définition du pourcentage massique, j'exprime les masses d'hydroxyde de sodium et de solution en fonction des données et j'arrive au résultat.
Donc STOP, reprends tout à zéro : relis mon message de 12:21 avec un papier et un crayon à la main. Écris ce que valent les massages d'hydroxyde de sodium et de solution, remplace-les dans la définition du pourcentage massique et tu devrais obtenir la même formule que celle qui est encadrée dans mon message de 12:21. Ensuite, tu n'auras plus qu'à faire le calcul !
Bonsoir, désolée de l'intrusion mais j'aurais voulu savoir si mon exo t'inspire, masterrr (cf message de 12:36). Merci
Bonsoir, désolée de l'intrusion mais j'aurais voulu savoir si mon exo t'inspire, masterrr (cf message de 12:36). Merci
Bonsoir -Romane-,
De quel exercice parles-tu ? Tu es sur plusieurs exercices en même temps alors...
Tu parles de celui-là :
Au passage, travailler sur plusieurs exercices en même temps sur le forum est tout sauf une bonne idée : je ne vois pas comment tu peux te consacrer pleinement à un exercice si tu es sur plusieurs fronts...
donc Pm=(C*M)/ mais je ne sais pas si je dois remplacer C par 0,125 ou 6,25 et comment je trouve la valeur de
mais je ne sais pas si je dois remplacer C par 0,125 ou 6,25 et comment je trouve la valeur de  ?
?
Il s'agit de la masse volumique de la solution : elle est donnée dans l'énoncé !
Il faut, bien entendu, prendre la concentration C=6,25 mol/L (sinon j'aurais écris Cs !). Si tu prends Cs, tu obtiens la masse de la solution diluée ! Toi tu veux la masse de la solution totale : celle du déboucheur d'évier (la solution S n'a servie qu'au dosage).
Et les unités alors ? Tu as pris la masse molaire en g/mol et la masse volume en kg/L. D'un côté tu prends des g et de l'autre des kg : ça ne peut pas coller ! Il faut choisir : soit l'un, soit l'autre (et peu importe, le résultat sera le même mais il faut être cohérent avec les unités).
Au passage, tu reverras tes chiffres significatifs pour les concentrations (je t'avais fait la remarque d'ailleurs...).
Ici, il faut bien entendu reprendre la valeur la plus précise pour arrondir à la fin mais lorsque tu donne ton résultat pour les concentrations à la question précédente, attention aux chiffres significatifs (ce sont des points bêtement perdus au BAC).
donc, Pm=[(6,25*40)/1,208.103]*100=20,7% mais après, je ne sais jamais comment faire avec les chiffres significatifs
C'est ça 
Pour les chiffres significatifs, c'est très simple : ton résultat ne doit pas comporter plus de chiffres significatifs que la donnée la moins précise.
Pour savoir combien de chiffres significatifs comporte une donnée, il faut l'écrire en notation scientifique.
Ici, en notation scientifique, tu as . Et maintenant tu comptes le nombre de chiffres : il y en a quatre d'où quatre chiffres significatifs.
Si tu prends 0,0001, en notation scientifique ça donne : il n'y a donc qu'un seul chiffre significatif.
ok. alors si on donne dans un exo les valeurs suivantes: n=2,2 mol, M=4,45 g/mol et C=11,5 mol/L tous les résultat devront avoir 2 chiffres significatifs ?
Voilà : n a deux chiffres significatifs, M en a trois et C en a trois. Tous les résultats doivent donc avoir le même nombre de chiffres significatifs que la donnée la moins précise : c'est-à-dire deux ici.
Le facteur de dilution est égal à 50.
le rapport des volumes de la fiole jaugée et de la pipette est égal à 50 .
volume fiole jaugée = 500 mL
volume pipette = 500 / 50 = 10 mL.
matériel nécessaire : fiole jaugée 500 mL; pipette 10 mL+ pipeteur
se munir de gants et de lunette de protection pour manipuler la solution commerciale corrosive.
L'ajout d'eau dans le becher permet à la sonde du pH-mètre d'être correctement immergée.
L'eau n'apporte quasiment pas d'ion hydroxyde, le résultat du dosage n'est pas faussé.
H3O+ + HO- --> 2H2O totale, exothermique
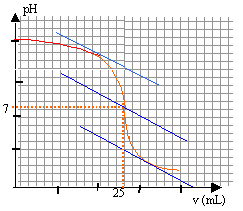
à l'équivalence les quantités de matière d'acide et de base sont stoéchiométriques.
Avant l'équivalence la base est en excés, après l'équivalence l'acide est en excès.
CsVs = CaVa
Cs= 0,1*25/20=0,125 mol/L
C= 50 Cs = 6,25 mol/L.
la zone de virage de l'indicateur coloré doit contenir le pH du point équivalent (pH=7 dans ce cas)
donc bleu de bromothymol
masse molaire de la soude : 23+16+1 = 40 g/mol
masse de soude dans la solution du commerce : 6,5*40 = 250 g
masse de 1L de ce produit commercial : 1208 g
pourcentage massique de soude : 250/1208 *100 = 20,7 %
écart relatif : (20,7 - 20 )/ 20 *100 = 3,5%