Inscription / Connexion Nouveau Sujet
dosage colorimétrique de l'aluminium
Bonjour, j'ai un exercice à faire mais je n'arrive pas à répondre à tout, ouvrez-vous m'aider svp ? Merci d'avance  (je met mes réponses en bleu)
(je met mes réponses en bleu)
L'aluminium est reconnu pour ses effets néfastes à haute dose sur le système nerveux. Les cellules du cerveau des patients atteints d'Alzheimer contiennent de 10 à 30 fois plus d'aluminium que la normale. L'institut de la Veille sanitaire a réalisé en 2003 une étude poussée qui montre le manque de données suffisantes pour confirmer ou infirmer les conséquences de l'aluminium sur la santé. Les études ont porté surtout sur la qualité des eaux utilisées pour la boisson, mais pas sur les effets des emballages en aluminium.
D'après un article de Wikipédia
Les normes actuelles tolèrent une concentration maximale en aluminium de 7,4 µmol·L-1 pour l'eau potable
Le but de cet exercice est d'exploiter une analyse par spectrophotométrie afin de s'assurer qu'un échantillon d'eau vérifie ce critère.
Préparation de la gamme d'étalon
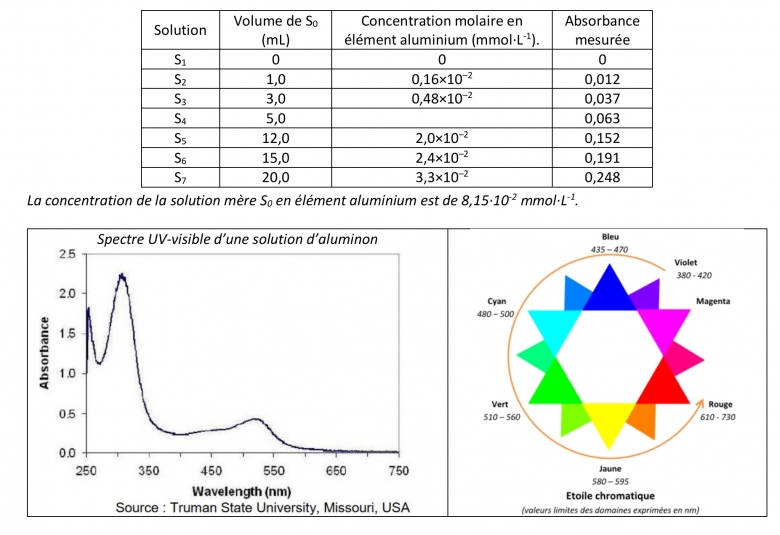
On fait réagir les ions aluminium III, contenus dans une solution incolore, avec un colorant appelé aluminon présent en large excès. Une nouvelle espèce chimique colorée est ainsi obtenue par une transformation chimique supposée totale. Sept solutions sont préparées de la façon suivante : il faut placer dans une fiole jaugée de 50,0 mL, 5 mL d'une solution d'aluminon, 20 mL d'une solution tampon permettant de maintenir le pH à 4,8, un certain volume de solution S0 précisé dans le tableau placé à la suite de l'exercice et compléter jusqu'au trait de jauge avec de l'eau distillée. Après homogénéisation et un temps d'attente de 15 minutes, les échantillons sont analysés au spectrophotomètre.
images
Questions :
1. En vous appuyant sur le spectre UV-visible d'une solution d'aluminon ci-dessus, justifier l'utilisation du spectrophotomètre et préciser la longueur d'onde sur laquelle celui-ci a dû être réglé pour effectuer les mesures d'absorbance.
On utilise un spectrophotomètre pour mesurer l'absorbance de la solution. La longueur d'onde a dû être réglé sur la longueur d'onde (je ne sais pas ?)
2. Expliquer la démarche permettant de déduire la couleur de l'aluminon en solution. Préciser cette couleur.
Sur le spectre UV-visible de la solution d'alumion, on observe que l'absorbance est beaucoup plus élévée vers la longueur d'onde 300-350nm. D'après l'étoile chromatique, la couleur correspondant à cette longueur d'onde est le magenta
3. Quel est le rôle de la solution S1 qui apparaît dans cette série de mesures ?
La solution S1 est une solution "témoin" de départ, dans laquelle il n'y a pass du tout de solution S0, donc la concentration molaire et l'absorbance sont nulles.
4. Parmi la liste suivante, préciser la verrerie qui permet de rélever un volume de 5,0 mL de solution mère S0 pour réaliser au mieux la solution S4 :
bécher de 100 mL, éprouvette graduée de 10 mL, pipette jaugée de 5 mL, pipette graduée de 10 mL.
bécher -> non, ce n'est pas précis. Il n'y a pas de graduation à 5mL
éprouvette graduée -> oui, il y a assez de graduations pour être suffisamment précis
pipette jaugée 5mL -> oui, on prélève la solution S0 jusqu'au trait de jauge
pipette graduée 10mL -> oui, il y a des graduations, ce qui permet de verser exactement 5mL
3.5. Calculer la concentration molaire en élément aluminium de la solution S4.
C = n/V
avec V = 5,0mL (donc 5,0*10-3L
et n = ??
Dosage de la teneur en aluminium de l'échantillon
3.6. L'absorbance d'un échantillon d'eau donne une valeur de 0,12. En déduire la concentration molaire en élément aluminium pour cette eau. Cette eau respecte-t-elle le critère de potabilité pour l'élément aluminium ? Expliquer l'intérêt de la zone graphique ci-dessous qui doit servir et être rendue avec la copie. (image de papier millimétré)
je ne sais pas comment déduire la concentration molaire.
Dans la zone graphique, on trace une courbe d'étalonnage et on peut retrouver la concentration par lecture graphique.
3.7. Est-il possible d'analyser, avec cette technique, des échantillons d'eau ayant une concentration molaire en élément aluminium environ 10 fois supérieure à celle de la solution S7 ? Pour quelle raison ? Que faut-il faire ?
Bonsoir,
1. et 2. Lire attentivement cette fiches pour peaufiner tes réponses :
![]() [lien]
[lien]
3. C'est pour s'assurer que l'appareil est correctement étalonné
4. A revoir : seule une pipette jaugée apporte le niveau de précision nécessaire : ![]() [lien]
[lien]
5. Appliquer la méthode de cette fiche : ![]() [lien]
[lien]
6. Exploiter le graphique A = f(C) comme proposé dans cette fiche : ![]() [lien]
[lien]

Bonjour,
Ce n'est pas comme cela que la fiche propose le raisonnement, il faut des phrases pour expliquer ce que tu fais.

données :
Solution mère : solution S0 en élément aluminium
* de concentration C0 = 8,15.10-2mol/L
* de volume V0 = 5,0 mL
Solution fille : solution diluée S en élément aluminium
* de concentration C = ?
* de volume V = 5,0 mL.
L'ajout d'eau ne modifie pas la quantité de matière de soluté. Donc, on a :
C0.V0 = C.V
Ainsi la concentration vaut :
C =
C =
Tu t'es emmêlée les pinceaux :
Solution mère : solution S0 en élément aluminium
* de concentration C0 = 8,15.10-2mol/L
* de volume V0 = 5,0 mL
Solution fille : solution diluée S en élément aluminium
* de concentration C = ?
* de volume V = 50 mL.
L'ajout d'eau ne modifie pas la quantité de matière de soluté. Donc, on a :
C0.V0 = C.V
Ainsi la concentration vaut :
C =
C =

Bonjour,
- Une question à gbm : si on règle le spectroscope sur la longueur d'onde pour laquelle l'absorbance de l'aluminon est maximale, c'est à dire pour 330nm environ, comme cette longueur d'onde est dans l'UV, l'aluminon va émettre aussi dans l'invisible, donc à mon avis, aucune couleur n'apparaitra, non ?
Merci d'avance
Bonjour Chimival,
En effet, la longueur d?onde du spectrophotomètre correspond à la longueur d'onde de la lumière la mieux absorbée par les solutions étalons.
Mais ici, on choisit la longueur d'onde pour laquelle la solution colorée étudiée présente un maximum d'absorption : dans le domaine du visible, l'absorbance est par la suite mesurée à 525 nm.
Merci de ta vigilance 
Oui mais tu n'as pas fourni le résultat final, ni son unité !

C =


