Inscription / Connexion Nouveau Sujet
Dm de spécialité physique chimie
Bonjour ,
J'ai un dm pour la rentré je m'y prends un peu à l'avance car je ne comprends pas ce qu'il faut faire le dm est composé de 5 documents et une question je ne vois pas les états intérmédiaire c'est pourquoi je poste ici afin que quelqu'un m'aide merci d'avance.
la question est la suivante :
Le vin étudié présente-t-il un risque de casse ferrique?
Pour répondre a cette question il faudra :
-déterminer la concentration massique en fer des solutions 1à 6
-Tracer une courbe d'étalonnage et l'exploiter.
J'ai oublié d'envoyé le dm
Je n'arrive pas à mettre ma photo quelqu'un peut m'aider?><
Salut  !
!
Regarde ici : ![]() [lien]
[lien]
Si ça ne va pas mieux je te guiderai
Houla oui mais pour le coup c'est illisible. Tu as moyen de séparer en deux ou trois images plus petites stp ? Avec Paint par exemple ça se fait en deux deux.
Je crois que je vais tous recopier à la main se soir dès que j'aurais plus de temps parce que je n'y arrive pas :S
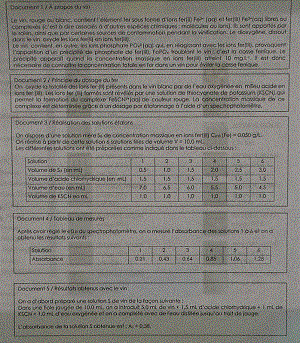
Document 1 / A propos du vin
Le vin rouge ou blanc , contient l'éléments fer sous forme d'ions fer (II) Fe2+(aq) et fer(III) Fe3+(aq) libre ou complexés (c'est à dire associés à d'autres espèces chimiques : molécules ou ions). Ils sont apportés par le raisin , ainsi que par certaines sources de contamination pendant la vinification.Le dioxygène , dissout dans le vin , oxyde les ions fer (II) en ions fer (III).
Le vin contient , en outre , les ions phosphate PO4^3-(aq) qui , en réagissant avec les ions fer (III) , provoquent l'apparition d'un précipité de phosphate de fer (III) , FePO4 troublant le vin : c'est la casse ferrique. Le précipité apparrait quand la concentration massique en ions fer (III) atteint 10 mg/L. Il est donc nécessaire de connaitre la concentration totale en fer dans un vin pour éviter la casse ferrique.
Document 2/Principe du dosage du fer
On oxyde la totalité des ions fer (II) présents dans le vin blanc par de l'eau oxygénée en milieu acide en ions fer (III). Les ions fer (III) formés sont révélés par une solution de thiocyanate de potassium(KSCN) qui permet la formation du complexe FeSCN^2+(aq) de couleur rouge. La concentration massique de ce complexe est détérminée grace à un dosage par étalonnage à l'aide d'un spectrophotomètre.
Document 3/Réalisation des solutions étalons
On dispose d'une solution mère S0 de concentration massique en ions fer (III) Cm0(Fe)=0,050g/L.
On réalise à partir de cet solution 6 solutions filles de volume V=10,0 mL.
Les différents solutions ont été préparées comme indiqué dans le tableau ci-dessous :
| SOLUTION | 1 | 2 | 3 | 4 | 5 | 6 |
| Volume de S0(en mL) | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 |
| Volume d'acide chlorhydrique(en mL) | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 | 1,5 |
| Volume d'eau(en mL) | 7,0 | 6,5 | 6,0 | 5,5 | 5,0 | 4,5 |
| Volume de KSCN (en mL) | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
Document 4 /Tableau de mesures
Après avoir réglé le "0" du spectrophotomètre , on a mesuré l'absorbance des solutions 1 à 6 et on a obtenu les résultats suivants :
| Solution | 1 | 2 | 3 | 4 | 5 | 6 |
| Absorbance | 0,21 | 0,43 | 0,64 | 0,85 | 1,06 | 1,28 |
Document 5 /Résultats obtenus avec le vin
On a d'abord préparé une solution S de vin de la façon suivante :
Dans une fiole jaugée de 10,0 mL , on a introduit 5,0 mL de vin + 1,5 mL d'acide chlorhydrique + 1 mL de KSCN + 1,0 mL d'eau oxygénée et on a complété avec de l'eau distillée jusqu'au trait de jauge.
L'absorbance de la solution S obtenue est : As=0,38.
Problème : Le vin étudié présente -t-il un risque de casse ferrique?
Pour répondre à cette question , il faudra :
-Déterminer la concentration massique en fer des solutions 1 à 6.
-Tracer une courbe d'étalonnage et l'exploiter.
| Solution | 1 | 2 | 3 | 4 | 5 | 6 |
| Volume de S0(en mL) | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| Volume d'acide chlorhydrique(en mL) | 1.5 | 1.5 | 1.5 | 1.5 | 1.5 | 1.5 |
| Volume d'eau(en mL) | 7.0 | 6.5 | 6.0 | 5.5 | 5.0 | 4.5 |
| Volume de KSCN (en mL) | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
désolée c'est la première fois que je poste sur se site
Re,
Si si je suis là mais il faut me laisser le temps de faire mon exo sachant que je bosse en parallèle 
Alors avec les volumes tu peux calculer les facteurs de dilution de chaque solution, c'est ce que je te conseille de faire en premier.
Ensuite tu utilises directement la concentration de la solution mère pour calculer la concentration molaire de chaque solution.
Puis tu utilises la masse molaire du fer pour avoir leurs concentrations massiques respectives.
Pour ta deuxième question utilise le tableau avec les absorbances 
Re,
Si si je suis là mais il faut me laisser le temps de faire mon exo sachant que je bosse en parallèle

Alors avec les volumes tu peux calculer les facteurs de dilution de chaque solution, c'est ce que je te conseille de faire en premier.
Je peux le faire à partir de quelle formule c'est pas C x V ?
Pour une dilution c'est C*V = C'*V'
Cmo=0.050g/L
Donc il faut faire pour la 1ère solutions
0.05*0.050*10.0
10.0 étant le volume V
c'est ça si j'ai bien compris? et il faut calculer pour les 6 solutions?
Non c'est 0,05*0,05 = 10*C'
et tu cherches C'
il faut donc réaliser un produit en croix
0,05*0,05=10*C'
C'=0,05*0,05/10
C'=2,5*10^-4
c'est bien le bon résultat?
et je dois l'appliquer pour les 6 autres claculs au fur et a mesure que le volume S0 change?
l'unité sera g/mL ?
voici les autres calculs
S2 = 0,5*1,0/10 =0.05
S3=0,5*1,5/10=0.075
S4=0,5*2,0=0,1
S5=0,5*2,5=0.125
S6=0,5*3,0=0.15
Si je ne me suis pas trompé sa doit etre ça
g/L
Avec les unités c'est ça. Tu as donc toutes tes concentrations massiques, pas besoin d'aller plus loin dans les calculs
Par contre pour les unites dans le tableau il est indiqué que c'est en mL et on multiplie avec des g/L et pour diviser par des mL(10 mL) le volume V
on a le droit de faire ça?
Ce n'est pas grave puisque tes deux volumes sont en mL. Tu as donc un rapport entre deux volumes, donc un rapport sans unité.
A toi pour la courbe. Tu as les concentrations et les absorbances, c'est parti
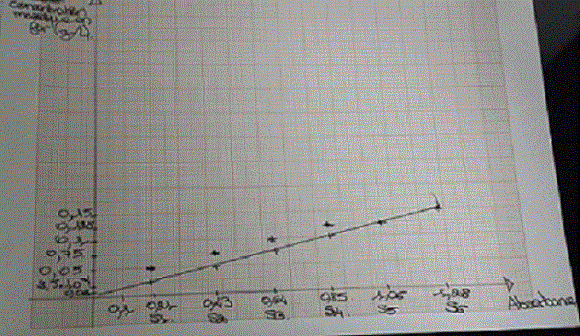
Pour la courbe je fais les concentrations (g/L) en fonction des absorbances? si j'ai bien compris?
Il ne faut rien faire de plus pour l'étape 1 ?
je vois une droite qui semble passer par tous les points. Tu dois récupérer le coeff directeur.
Tu as vu la loi de Beer-Lambert en cours ?
L'année derniere oui si me dit vagueument quelques chose cetait pas pour dire que si la droite passé par 0 alors il y avait situtation de proprotionnalité?(ou je confond)
a= k*c
k une constante et lorsque je calcule je trouve
1.28/0.15=8.53
1.06/0.125=8.48
0.85/0.1=8.5
en moyenne on peut retenir 8.5 si je ne me trompe pas
La réponse au problème "le vin étudié presente t il un risque de casse ferrique" je le sais comment?
J'ai juste pour le coef directeur ect tu es sur? 
pardon l'absorbance étant de 0,38 je lis d'après la courbe que la concetration massique est d'environ 0,6 donc
0,6/1*10^-3=600 mg/L
c'est bien la concentration massique qu'il faut divisé?
et donc 600 est supérieures 10 mg/L
par conséquent il y a un risque de casse férique?