Inscription / Connexion Nouveau Sujet
cinétique chimique
Bonjour a tous
J ai un problèmes de cinétique dont l énoncé et ci dessous
Dans la cinétique chimique , la constante de vitesse (ou coefficient de vitesse) k est une mesure de la vitesse d une réaction chimique .
On se propose de déterminer la constante k de vitesse d une réaction chimique . on donne les potentiels standards d oxydoréduction :
I2 + e^- >>> I^- E1= 0,622v
S208^2- +2e^- ___>2SO4^2- E2= 2,01 v
S406^2- + 2e^- __>2S203^2- E3= 0,08v
On étudie l action de l iodure de potassium (k+;I-) sur l ion peroxydisulfate (S208^2-)
Pour cela , on prépare 20ml d une solution d iodure de potassium 25/30 mol /l et on complète a 250 ml . on obtient une solution sA
On prépare de même 20 ml d une solution de peroxodisulfate de sodium a 25/60,mol /l et on complète a 250 ml on obtion Sb
A l instant t=o on mélange les deux solutions sa et SB pour un mélange de 500ml toutes les 5 minutes on prélevés un volume v= 20ml de ce mélange on rajoute approximativement 100ml d eau et on dose l iode en solution par un volume v1 d une solution de thiosulfate (S203^2-) de concentration molaire c1 =0,01mol/l
Les résultatsdont consignés dans le tableau ci dessous
T(min): 0 5 10 15 20 25 30 35 40 45 50 55 60 65 70
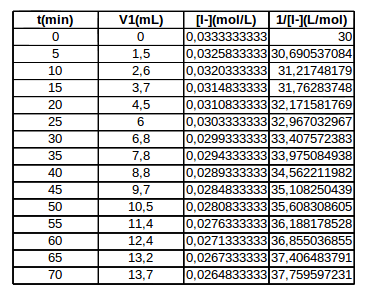
Pour chaque temps t les volume v1 correspondantes sont : 0 1,5 2,6 3,7 4,5 6 6, 8 7,8 8,8 9,7 10,5 11,4. 12,4 13,2. 13,7
1) écrire l équation déjà FAI
S208^2- + 2I- ___> I2 +2SO4^2-
2)pourquoi rajoute t on de l eau a chaque instant c est pour le trempe
3) établir la relation entre [S208^2- ] et [I-]
J ai dit que [I-] = 2x [S208^2-]
4)0n pose v = k [I-][S208^2-]
La réaction est d ordre un a chacune des deux
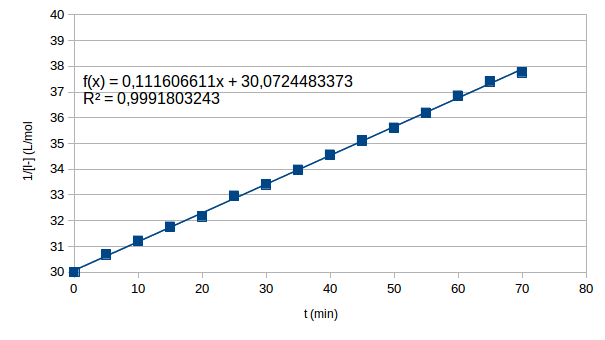
Montre que 1/[I-] est une fonction affine du temps j ai du 1/[I-]=1/[I-]o +kt
Et sachant que v= - 1/alpha d[I-] /dt ou alpha est son clef dans la réaction
5) écrire l équation entre l iode formé et le thiosulfate on a
2S203^2- + I2___> 2I- + S406^2-
Établir une formule liant [ I-] et le volume v1 de thiosulfate c est par la que j zi eu des difficultés car on m à demande après de remplir le tableau la concentration [I-] et celle de 1/[I-] puis représenter le graphe de 1/[I-] f(t)
Aider moi svp c est long mais je bloque seulement dans la dernière question je voulai seulement que vous comprenez l exo
Merci
Bonjour
Si quelques uns peut me répondre je me Biloque depuis pour Ka dernier question a savoir la relation de v1 et [I-]
Enfaite ici il s agit d un dosage retour bon j avais eu en essayant [I-] =5.10^-5 V1 mais les donner que j ai eu pour traces la courbe 1[I-] ne me donne pas une droite hors ça devrai l être
Merci d avance
Bonjour
comme demandé, je réponds uniquement à la question 5. La quantité de diode prélevée pour effectuer le dosage par les ions thiosulfate est :
n=[I2].v
Selon l'équation bilan du dosage, cette quantité est la moitié de la quantité d'ions thiosulfate nécessaire au dosage :
n=[I2].v=½c1.v1
Selon le tableau d'avancement de la réaction entre les ions iodure et les ions peroxodisulfate :
[I2]=½([I-]o-[I-])
En reportant dans l'équation précédente et en simplifiant, on obtient :
Tu trouveras ci-dessous le tableau des valeurs numériques obtenu à l'aide d'un tableur ainsi que la courbe. Il s'agit bien d'une droite dont le coefficient directeur te donne la valeur de k. Les points expérimentaux sont effectivement très proches d'une droite comme le montre le carré du coefficient de corrélation extrêmement proche de 1.
Bonjour
Bon ce que je ne comprend pas c est que ta f ait pour obtenir
[I2]= 1/2([I-]o-[I-]) et pour la concentration de [I-] qu on a parlé tout au long de l exercice c est restant donc et pas réagit et puis pour les valeurs des concentrations de 1/[I-] dans le tableau c est arrondi ou bien
Merci d'avance et aussi de répondre a mon demande
Et consernant la concentration [I-]o c est pas 25/30 (mol/l) comme ça ça changerai les valeur du tableau
Merci
La quantité initiale d'ions iodure est :
C'est volontaire si je ne simplifie pas. Ces 20mL de solution concentrée sont ajoutés à de l'eau de façon à obtenir la solution Sa de volume 0,250L qui sera, à la date t=0,mélangée à la solution Sb de volume 0,25L. La quantité no d'ion iodure se retrouve donc à la date t=0 dans une solution de volume 0,5L. La concentration initiale en ions iodure est donc :
Je ne convertis pas en valeurs décimales puisque les mesures ultérieures portent sur les inverses de concentrations... Tu peux calculer de même la concentration en ions peroxodisulfate : tu obtiens la moitié de la valeur précédente : le mélange initial est réalisé dans les proportions stchiométriques.
Je remplis alors un tableau d'avancement en notant x l'avancement volumique :
| Espèces chimiques | I- | S2O82- | I2 | SO42- |
| concentrations initiales (mol/L) | 0 | 0 | ||
| concentrations à la date t | x | 2x |
Tu vois bien ainsi que :
[I-]=[I-]o-2[I2] : relation que j'ai utilisée dans mon message précédent...
J'ignore tout des études que tu poursuis mais cet exercice me parait assez difficile au niveau terminale...


