Inscription / Connexion Nouveau Sujet
Chimie minérale
Bonsoir, merci de m'aider
ÉNONCÉ
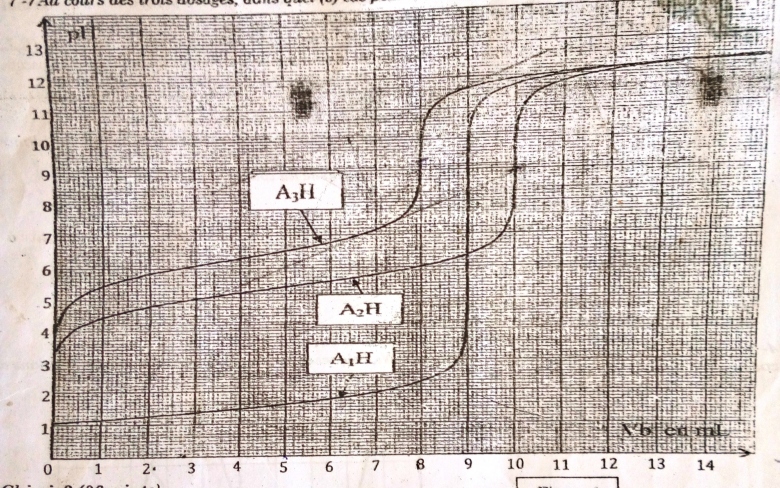
Les graphiques de la figure 1 réprésentent les dosages de trois solutions H,
H et
H par une solution d'hydroxyde de sodium de concentration
= 0,1mol/L.
Le volume d'acide dosé dans les trois cas est = 10mL
1. On désigne par AH un acide qui peut être fort ou faible. Ecrire l'équation chimique bilan de la réaction de dosage de l'acide AH par la solution d'hydroxyde de sodium si :
1-1- L'acide AH est fort
1-2-L'acide AH est faible
2-1- Déterminer les coordonnées des points d'équivalence de chaque courbe(On notera ,
,
)
2-2-En justifiant, en déduire d'après les résultats précédents les acides faibles.
3/Déterminer la concentration molaire initiale de l'acide fort
4/4-1-Déterminer le Pka de chaque acide faible.
4-2- E n justifiant classe ces acides d'après leurs forces
REPONSES
2-1
( 9mL ; 7 ) ;
(10mL ; 9 ) ;
( 8mL ; 9,2 )
2-2- H et
H
3- Je trouve C = 10^-7 mol/L
4-1-Je ne vois pas comment faire
S'il vous plait j'ai vraiment besoin d'aide.
Bonjour,
Je n'ai pas vérifié les réponses que tu as données.
Question 4 :
Pour les dosages des acides faibles les pK correspondent aux pH des points de demi-équivalence.
Je n'ai pas vérifié les réponses que tu as données.
C'est dommage j'aurai bien voulu que quelqu'un me corrige
Mais sinon pour la question 3 ce que j'ai trouvé c'est juste ?
4/ Ok je trouve
Pour
Pour
je ne comprends par pourquoi je trouve ça parce après on me dit que l'un des deux acides faibles est l'acide nitreux
je ne comprends par pourquoi je trouve ça parce après on me dit que l'un des deux acides faibles est l'acide nitreux
Ignorez cette question j'ai compris !
C'est sur ces deux questions que je bloque à présent
1-Pourquoi les trois courbes sont confondues au-delà de
2- Au cours des trois dosages, dans quel (s) cas peut-on obtenir une solution tampon ?
Merci
C'est dommage j'aurai bien voulu que quelqu'un me corrige
Je ne corrige que les réponses justifiées.
C'est sur ces deux questions que je bloque à présent.
Merci de poster en une seule fois la totalité de l'énoncé.
Désolé
ENONCE
Les graphiques de la figure 1 réprésentent les dosages de trois solutions H,
H et
H par une solution d'hydroxyde de sodium de concentration
= 0,1mol/L.
Le volume d'acide dosé dans les trois cas est = 10mL
1. On désigne par AH un acide qui peut être fort ou faible. Ecrire l'équation chimique bilan de la réaction de dosage de l'acide AH par la solution d'hydroxyde de sodium si :
1-1- L'acide AH est fort
1-2-L'acide AH est faible
2-1- Déterminer les coordonnées des points d'équivalence de chaque courbe(On notera ,
,
)
2-2-En justifiant, en déduire d'après les résultats précédents les acides faibles.
3/Déterminer la concentration molaire initiale de l'acide fort
4/4-1-Déterminer le Pka de chaque acide faible.
4-2- E n justifiant classe ces acides d'après leurs forces
5-Pourquoi les trois courbes sont confondues au-delà de = 12mL ?
6- Au cours des trois dosages, dans quel (s) cas peut-on obtenir une solution tampon ?
Je bloque sur les deux dernières questions. Merci
Je ne corrige que les réponses justifiées
D'accord c'est vrai que vous n'avez pas le graphe.
Mais c'est par la méthode des tangentes parallèles que j'ai fait

Je résume :
Questions 1.1 et 1.2 : non traitées.
Question 2.1 : Méthode des tangentes : OK
Question 2.2 Réponse non justifiée.
Question 3 : Réponse non justifiée.
Question 4.4.1 : Réponse non justifiée.
Ok alors je reprends
Reponses
1-1- on a
1-2-
2-2-On a et
or lors d'une réaction entre un acide faible et une base forte
alors
et
sont des acides faibles.
3/ Ici j'ai vu mon erreur donc on a :
A l'équivalence acido-basique de cette relation j'ai pu tirer Ca de l'acide fort
4-4-1- A la demi-équivalence c'est a dire on a
, ainsi grâce au graphe je détermine les pka respectifs des acides
Désolé si j'ai tout survolé je voulais plus qu'on s'interresse sur la question que je ne comprenais pas
OK
Question 5 :
Quel que soit l'acide dosé, la proportion d'hydroxyde de sodium dans le mélange devient fortement prépondérante et ce mélange finit par avoir le même pH que la seule solution d'hydroxyde de sodium (laquelle a un pH=12)
Question 6 :
Une solution tampon "idéale" est composée par le mélange à concentration égales d'un acide et de sa base conjuguée.
Donc pour la dernière question je peux dire :
Lorsque le mélange entre les Acides A1H et A2H avec l'hydroxyde de sodium se fait à concentration égale jusqu'à la demi-équivalence
Ah d'accord
Donc au delà de l'équivalence OH- est en excès merci beaucoup
Etre au delà de l'équivalence ne suffit pas, il faut l'avoir dépassé nettement.
Lorsque le mélange entre les Acides A1H et A2H avec l'hydroxyde de sodium se fait à concentration égale jusqu'à la demi-équivalence.
Non
Il ne s'agit pas du mélange A1H avec A2H mais de celui de
A2H et A2- d'une part et A3H et A3- d'autre part.
Dans les deux cas quand la demi-équivalence est atteinte, la solution obtenue correspond à la définition d'une solution tampon "idéale"


