Inscription / Connexion Nouveau Sujet
chimie graphique
Bonsoir, pourriez-vous m'aider à comprendre comment faire juste cet exercice de chimie? Le voici:
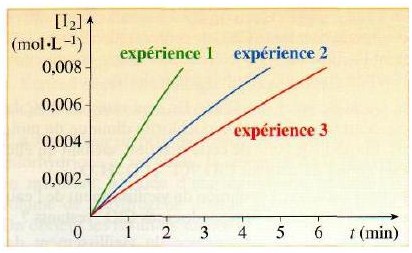
En milieu acide, on réalise l'oxydation des ions iodure I- par l'eau oxygénée, solution aqueuse de peroxyde d'hydrogène H202. On étudie la concentration du diiode formé au cours du temps, pour différentes conditions expérimentales. Les résultats obtenus sont donnés par le graphe ci-après.
a. Entre les trois expériences, seule la température a changé. Quelle expérience a été réalisée à la température la plus élevée ? Justifier la réponse.
b. Écrire l'équation chimique de la réaction étudiée, sachant que l'eau est la forme réduite de l'eau oxygénée.
c. Déterminer l'état final des trois systèmes chimiques, sachant qu'on a utilisé les réactifs suivants :
- 5 mL d'eau oxygénée acidifiée, de concentration 0,02 mol.L-1 ;
- 5 mL de solution d'iodure de potassium, de concentration 0,1 mol.L-1.
d. Indiquer qualitativement l'allure du graphe que l'on obtiendrait, à la même température que celle de l'expérience 1, avec une solution d'iodure de potassium de concentration 0,2 mol.L-1. Justifier la réponse.
a)Plus la température est élevée plus la vitesse de réaction est grande. D'après le graphe c'est donc l'expérience 1 qui a été réalisée à la température la plus élevée. Mais comment "justifier" de manière précise à part en comparant les durées de réactions sur l'axe des abscisses?
b)Je trouve 2I- +H2O2 +2H+ = 2H2O2 + I2. Si c'est faux le reste sera faux aussi 
c)Qu'est ce que veut dire "les trois systèmes chimiques"? I-, H2O2 et H+? Les 3 expériences?
Moi j'ai considéré que ça voulait dire "quelle quantité de matière reste il à la fin de la réaction pour les trois réactifs?" Sauf que sur H+ on a aucune info sur la quantité de matière introduite 
Je trouve à l'état final 0mol de H2O2 et 3,0.10^-4 mol de I-...
d)Je ne vois pas comment faire pour le savoir.
Merci beaucoup
Bonjour
a) Très bien !! On justifie je pense en comparant les durées pour une meme concentration.
b) Oulah tu as voulu marqué 2H2O a droite non ?
c) Les 3 systèmes chimiques = les 3 expériences bien sur !!
Je pense qu'on peut négliger les ions H+. Ce sont des catalyseurs.
d) Il faut simplement tracer sans calculs préliminaires la droite. Il faut savoir si la droite a une pente + grande ou plus faible que celle déjà tracée !
Bonsoir 
b)Oui 1H2O à droite j'ai du faire une erreur de frappe
c)Oui mais dans les trois expériences on trouvera la même chose puisque c'est la même réaction  non?
non?
d)Quelle droite?
merci à toi 
b) non : 2H2O à droite !!
c) oui evidemment !! On aura le meme état final pour les 3 expériences !! On ne te demande pas l'état final pour chacun ca serait idiot!
d) non pardon ce n'est pas une droite, c'est une courbe ! Je n'ai pas bu rassure toi !
Encore une erreur de frappe  oui oui
oui oui
c)Que penses tu de mes valeurs trouvées plus haut?
d)Oui mais on trace cette courbe comment?
Je reviens demain pour continuer 
c) [H2O2]=0 mol et [I-]=4*10-4 mol !
d) En fait la courbe a tracer est exactement la meme que celle de l'expérience 1 ! Car de toute façon le réactif limitant est H2O2 ! Tu vois ce que je veux dire ?
d)Je ne vois pas 
c)xmax = 1,0.10^-4 mol mais comme on a le coefficient 2 devant I- il ne reste que 5,0.10^-4 -2(1,0.10^-4) = 3,0.10^-4 mol non?
c) exact !! J'ai oublié le coeff stoechio ! Excuse moi ! Donc c'est bon !
d) Du coup attends comme j'avais oublié ce coeff stoechio, il faut calculer la quantité de matière de I2 à l'état final ! Du coup tu peux tracer une esquisse grossière de la courbe que l'on doit obtenir (on te demande juste de tracer une esquisse pas point par point)
OK?
"il faut calculer la quantité de matière de I2 à l'état final" c'est 1,0.10^-4 mol? hm hm
Une esquisse de la courbe mais comment je sais à quoi ça va ressembler? Ca dépend de quoi?
merci
d) oui ca fait 1.0*10-4 mol car on n'a rien changer finalement. Ce n'est pas ca qu'il faut dire... Je m'égare... Non en fait il faut juste considérer qu'on a I- deux fois plus concentré au départ. Donc la vitesse de réaction sera accélérée car il y a deux plus de quantité de matière de I-. On atteindra donc plus vite la concentration en I2 de 0.008 mol/L (voir graphe) que pour l'expérience 1 ! Tu n'a splus qu'à tracer une courbe qui ressemble à celle tracées mais fais-lui une pente plus grande.
OK?
Ben si l'expérience dont on a écrit l'équation est la même que l'experience 1, rien ne change entre les courbes si? 
si car la concentration en I- a doublée !! Donc la réaction est accélérée ! Les ions I- plus nombreux réagiront plus vite avec H2O2. Le diiode sera plus vite formé.
OK?
Mais quelle est l'équation de la réaction de l'experience 1 dans ce cas? Je ne saisis pas la différence désolée 
l'expérience 1 c'était pour :
5 mL de H2O2 à 0.02 mol/L
5 mL de I- à 0.1 mol/L
Dans l'expérience dans la question d) on introduit :
5 mL de H2O2 à 0.02 mol/L
5 mL de I- à 0.2 mol/L
Donc c'est exactement la meme réaction que pour l'exp 1 mais on a mis deux fois plus de I- !!!
OK?


 Merci
Merci 

