Inscription / Connexion Nouveau Sujet
chimie - dosage par étalonnage
Bonjour, j'ai une question en particulier que je n'arrive pas à résoudre dans un exercice de chimie (terminale),
voici l'énoncé :
On cherche à doser une solution utilisee en hydrometallurgie pour realiser des depots de cuivre, elle contient des ions cuivre (II) et sulfates SO42- on dispose d'une solution S1 obtenue par dissolution dont l'equation est : CuSO4 -> Cu2+ + SO42-
1) Dosage par étalonnage utilisant l'absorbance
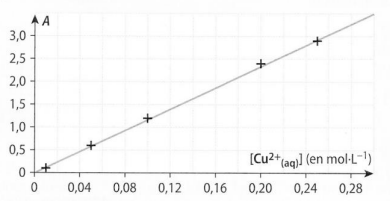
graphique de A en fonction de [Cu2+]
a) On preleve 10mL de S1 et on l'introduit dans une fiole jaugee de 50mL completee avec de l'eau distillee : l'absorbance de cette solution S2 vaut A=1.7
determiner la concentration en ions Cu2+ de S2
b) en deduire celle de S1
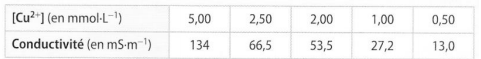
2)On prepare de nouvelles solutions etalons plus diluees de sulfate de cuivre dont on mesure la conductivité
(tableau)
a)Pourquoi n'utilise t on pas les solutions etalons de la q1
b)Placer sur un graphique conductivite en fonction de [Cu2+]
c) Donner l'expression litterale de la conductivité de la solution.en deduire que l'on peut ecrire sigma=(lambdaCu2+ + lambdaSO42-)[Cu2+]
Justifier l'allure de la courbe b
d)On mesure la conductivité d'une solution diluée 500 fois a partir de S1, sigma=43mS.m-1
Determiner la concentration en ions Cu2+ de cette solution, en deduire celle de S1
3)Validite des dosages
La solution S1 est préparée par dissolution d'une masse m=96.5g sulfate de cuivre, de masse molaire =249.6g.mol-1 dans l'eau distillee pour obtenir V=500mL de solution.
a)Determiner la concentration en ions Cu2+ de S1
b) Les dosages effectués vous paraissent ils donner des résultats conformes a cette valeur? que faudrait il savoir pour conclure?
Pour mes reponses:
1)a)0.15mol.L-1
b) 0.15mol.L-1 *5=0.75mol.L-1
2)a) absorbance utilise solutions colorees donc peu diluees contrairement conductivite (+ pas les memes appareils)
b) ca fait un graphique sous forme de fonction lineaire
c)sigma=lambdaCu2+*[Cu2+] + lambdaSO42-*[SO42-] donc je crois que
[Cu2+]=[SO42-] donc sigma=(lambdaCu2+ + lambdaSO42-)[Cu2+]
Et la courbe est lineaire car c'est un produit d'une constante et d'une variable (pas tres sure mais bon..:'))
d) C'est cette question qui bloque je ne trouve pas comment m'y prendre (et peut etre la suite aussi du coup)
Voila merci d'avance pour votre aide précieuse 
Bonjour,
Je veux bien t'aider mais je ne regarde pas des réponses qui ne sont pas du tout justifiées ou expliquées.
C'est primordial d'améliorer cela pour le bac ainsi que pour les études supérieures. A titre d'exemple, voici l'entête d'un sujet de concours d'écoles d'ingénieurs :
La présentation, la lisibilité, l'orthographe, la qualité de la rédaction, la clarté et la précision des raisonnements entreront pour une part importante dans l'appréciation des copies. En particulier, les résultats non justifiés ne seront pas pris en compte. Les candidats sont invités à encadrer les résultats de leurs calculs.

Ok merci je vais alors mieux expliquer cela dans cette réponse 
1)
a)par lecture graphique on voit que quand A=1.7, [Cu2+]=0.15mol.L-1
b)le facteur de dilution de la concentration est de 5 (car on preleve 10mL de S1 pour le completer avec de l'eau distillee jusqua 50mL) donc [Cu2+] de la solution non diluée S1 vaut 0.15*5=0.75mol.L-1
2)
a)la j'ai mis qu'on ne peut pas utiliser les solutions etalons de la q1 car l'absorbance se mesure avec des solutions moins diluees que la conductivite
b)(c'est juste un graphique trace et qui est lineaire)
c)on sait que l'expression de la conductivité vaut
 =
= i*
i* i
i
donc  =
= Cu2+*
Cu2+* Cu2+ +
Cu2+ +  SO42- *
SO42- * SO42-
SO42-
donc vu que [Cu2+]=[SO42-] (enfin je crois)  =(
=( Cu2++
Cu2++ SO42-)[Cu2+]
SO42-)[Cu2+]
La courbe obtenue prend la forme d'une fonction linéaire car la formule de la conductictivite indique le produit d'une variable[Cu2+] et d'une constante( +
+ )
)
d)je ne trouve pas a partir de la 
Merci de votre aide 

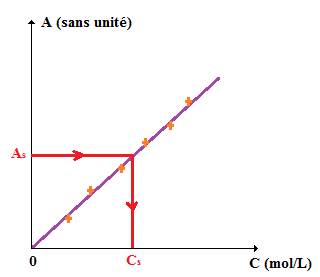
1. a. A justifier par un tracé de ce style :
b. Oui !
2. a. Tu n'expliques pas pourquoi
b. Peux-tu poster le graphique en question ?
c.
on sait que l'expression de la conductivité vaut
 =
= i*
i* i
iOK
[Cu2+]=[SO42-] (enfin je crois)
Justifie-le en écrivant l'équation de dissolution du sulfate de cuivre dans l'eau.
d. Tu ne peux pas utiliser le graphique que tu as tracé ?

Merci de votre reponse 
pour la 1, ok super je vais mettre un petit schema explicatif 
2)a) franchement je ne sais pas a part que ce n'est pas le meme appareil(spectrophotometre/conductimetre)
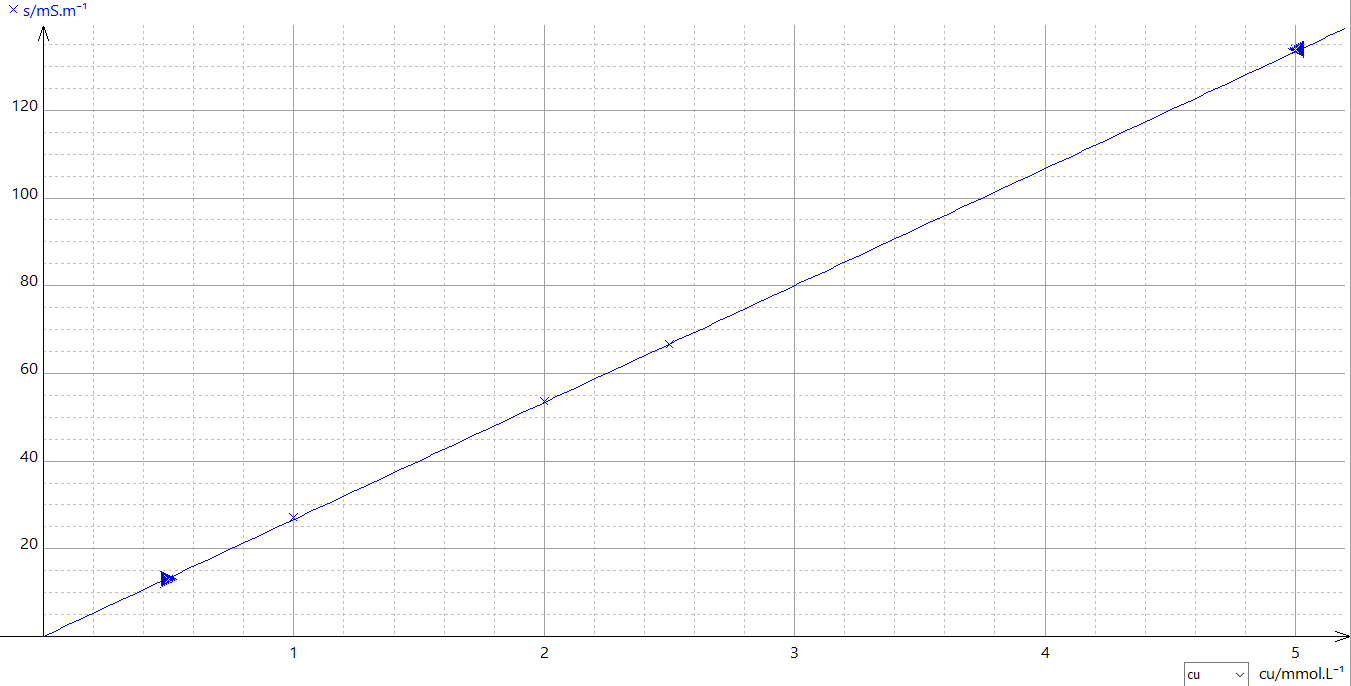
b) je joins le schema fait sur regressi (plus clair que le mien hihi)
c) je le justifie donc par CuSO4(s) ---> Cu2+(aq) + SO42-(aq)
d) je ne comprends pas comment utiliser le graphique tracé pour cette question desole... 
voila merci encore de votre aide 
1. a. OK
2. a. Il faut diluer le mélange pour se placer dans une certaine plage de conductivité (qui correspond à sa plage de mesure), sinon l'appareil n'est pas fiable.
b. Nickel !
c. Oui : CuSO4(s) ---> Cu2+(aq) + SO42-(aq)
donc pour 1 mole de sulfate de cuivre dissoute, il se forme 1 mole de Cu2+ et 1 mole de SO42- :
n(CuSO4) = n(Cu2+) = n(SO42-)
<=> C x V = [Cu2+] x V = [SO42-] x V si V est le volume de la solution
Finalement, C = [Cu2+] = [SO42-]
d.
On mesure la conductivité d'une solution diluée 500 fois a partir de S1, sigma=43mS.m-1
Determiner la concentration en ions Cu2+ de cette solution, en deduire celle de S1
Nous avons affaire à une nouvelle solution diluée (dont on connaît le facteur de dilution). Si sa conductivité est de 43 mS/m, tu peux reporter cette valeur sur l'axe des ordonnées et en déduire l'abscisse correspondante par le biais de la courbe tracée pour en déduire sa concentration.
Puis en déduire celle de la solution mère.

Ok merci beaucoup je crois avoir compris 
donc pour la d j'ai cherche [Cu2+] qui vaut donc 1.63 quand sigma vaut 43mS.m-1
est ce que il faut diviser par 500 1.63 vu que la solution est diluee 500 fois par contre svp?
Un résultat sans unité n'a aucun sens physique ou chimique 
Une solution mère est plus concentrée qu'une solution fille : conclusion ?
Oui mais écriture scientifique obligatoire.
Et si l'énoncé te donne 2 chiffres significatifs, il faut en donner que 2.
Une fiche de cours là-dessus si besoin : ![]() Les chiffres significatifs
Les chiffres significatifs
ok parfait donc ca fait :
[Cu2+]=1.6mmol.L-1 (la pas besoin d'ecriture scientifique je pense :'))
et la solution mere = 1.63mmol.L-1 * 500 = 8,2.10^2mmol.L-1
pour la q3a je voulais faire :
n(CuSO4)=m/M=96.5/249.6=0.39mol donc C=n/V=0.39/500.10-3=0.78mol.L-1
est ce que c'est bon svp  ?
?
OK pour la question 2.
Pour la question 3, il ne faut surtout pas faire des calculs intermédiaires. Mène le calcul littéral jusqu'à son terme et conclus par une application numérique.
On a vu que l'équation de dissolution est CuSO4(s) ---> Cu2+(aq) + SO42-(aq)
donc pour 1 mole de sulfate de cuivre dissoute, il se forme 1 mole de Cu2+ et 1 mole de SO42- :
n(CuSO4) = n(Cu2+) = n(SO42-)
<=> C x V = [Cu2+] x V = [SO42-] x V si V est le volume de la solution
Finalement, C = [Cu2+] = [SO42-]
Or par définition de la concentration en quantité de matière : C = n(CuSO4)/V si n est la quantité de matière en sulfate de cuivre dissoute.
Mais n(CuSO4) = m(CuSO4)/M(CuSO4)
si m(CuSO4) est la masse dissoute et M(CuSO4) sa masse molaire
Finalement, on peut écrire : [Cu2+] = C = m(CuSO4)/[M(CuSO4) x V]
Ok merci beaucoup pour les calculs intermediaires je ne savais pas 
Par contre j'ai vraiment pas compris la derniere question (b) svp qu'est ce qu'on doit repondre (oui/non/autre chose..) + la justification....
merci encore de votre aide 
Tu remarqueras que les questions 1, 2 et 3 nous ont permis de déterminer la concentration en quantité de matière de la même solution, suivant 3 méthodes : absorbance, conductimétrie et détermination directe.
Que peux-tu en dire ?

Alors pour la q1 on a trouve 7.5.10-1mol.L-1, pour la q2 on a trouve 8.1.10-1mol.L-1, (donc jusque la c'est plutot logique)mais pour la q3 j'ai trouvé 1.93.10-1mol.L-1 (peut etre que je me suis trompe dans le calcul du coup  ) donc je ne sais pas trop quoi en conclure surtout avec la 3eme methode...
) donc je ne sais pas trop quoi en conclure surtout avec la 3eme methode...
merci encore sinon 
Ah d'accord j'ai compris pourquoi  vous avez fait un petite erreur dans la formule C=n/V en marquant Cu2+] = C = m(CuSO4)/[M(CuSO4) x V] or c'est divisé par V et la ca donne bien 7.7.10-1mol
vous avez fait un petite erreur dans la formule C=n/V en marquant Cu2+] = C = m(CuSO4)/[M(CuSO4) x V] or c'est divisé par V et la ca donne bien 7.7.10-1mol 
donc est ce qu'on peut en conclure que les 3 techniques donnent a peu pres le meme resultat? ou est ce qu'il faut plus developper?
merci 
Je n'ai pas fait d'erreur, j'avais bien mis des crochets :
[Cu2+] = C = m(CuSO4)/[M(CuSO4) x V]
Ce serait bien de calculer les écarts relatifs par exemple dans un premier temps entre le résultat trouvé en question 3 (qu'on dira "théorique") avec les deux résultats expérimentaux trouvés.

Ah mince j'avais pas vu désolé  :(
:(
pour l'ecart relatif absorbance-theorique ca fait donc ((7.5.10-1 - 7.7.10-1)/7.7.10-1)*100
donc ca donne -2.6%
et pour l'ecart relatif conductivité-theorie ca fait ((8.1.10-1 - 7.7.10-1)/7.7.10-1)*100 et ca donne +5.2%
je rajoute donc ces deux valeurs dans ma reponse pour comparer les "experiences" au theorique : donc les dosages effectués donnent des résultats presque conformes a cette valeur.
Faut il rajouter qqchose a savoir pour conclure ou c'est bon ?
merci merci merci et encore desole pour l'erreur de la reponse precedente 

Il y a une valeur absolue dans le calcul de l'écart relatif, donc forcément positif 
Et donc quand tu fais des TP et que l'écart relatif est très en dessous de 20%, que conclus-tu ?
(ah oui mince j'avais totalement oublié les valeurs absolues oups)
bah je conclurais que l'ecart de valeur etant moindre les resultats experimentaux obtenus sont justes, la mesure ayant donc ete faite avec precision (?)
mais alors je ne comprends pas la question "que faudrait il savoir pour conclure?" (il faut repondre qu'il faut savoir la vraie concentration ou queqlue chose comme ca ou ??? franchement je ne comprends pas...)
Avec de tels écarts relatifs, les mesures opérées sont bonnes.
Ce qu'il faudrait savoir c'est l'incertitude de mesure liées à la verrerie utilisée, les appareils utilisés, etc.
Nous ne sommes pas dans un monde parfait, il y a toujours des incertitudes de mesure à considérer ...



