Inscription / Connexion Nouveau Sujet
chimie : deux demi piles Al3+ / Al et Cu2+/Cu
Bonjour,
j'ai un exercice de chimie à faire pour la rentrée dans ma nouvelle école et je suis bloquée. Si quelqu'un voulait bien m'aider ça serait super!
merci d'avance.
Voici l'énoncé :
On réalise la pile suivante : Al/Al2(SO4)3 (1M)/KNO3 (4M)/CuSO4 (1M)/Cu par association de deux demi piles Al3+/Al et Cu2+/Cu reliées par un pont salin constitué de KNO3 (4M). Les sulfatesde cuivre et d'aluminium sont des éléctrolytes forts donc totalement dissociés..
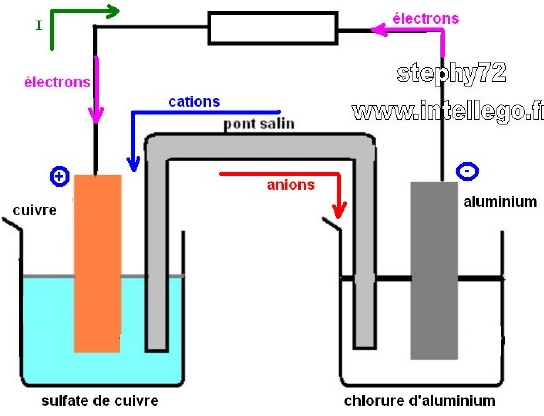
a) Proposer un montage expérimental de cette pile ; préciser la polarités des électrodes, leur nature, le sens du courant, le mouvement des électrons et le mouvement des anions.
b)Donner les degrés d'oxydation des différentes espèces présentes.
c) ecrire les deux demi reactions rédox ainsi que le bilan réactionnel.
d)Donner l'expression du potentiel de chaque électrode et leurs valeurs à l'instant initial.
e)Donner l'expression de la fem de cette pile. Quelle est cette valeur à l'instant initial et à l'équilibre.
f)En déduire la constante d'équilibre de la réaction d'oxydo réduction entre l'aluminium et le cuivre.
g) Que peut on en conclure. Quel sera le facteur limitant de cette pile?
données : Al3+/Al = - 1,662 Volts Cu2+:Cu = + 0,521 Volts
Pour la question a) j'ai fait le schéma ci joint et jai expliqué ce schéma en quelques phrases.
Pour la question b) je n'en ai aucune idée car au lycée je n'ai jamais entendu parler de degré d'oxydation.
c) les demi equations sont : Cu2+ + 2e- = Cu et Al= Al3+ + 3e-
le bilan réactionnel est donc : 3 Cu2+ + 2Al = 3 Cu + 2 Al3+
d) je ne sais pas ce qu'est le potentiel ni les valeurs a l'instant initial.
e)idem
f) k = [Al3+]² / [cu2+]^3 mais sans les valeurs de la question e) je ne peux pas faire le calcul
g) je suppose que K sera superieur à Qri, dans ce cas nous pourrons en conclure que la transformation se fait dans le sens direct.pour le facteur limitant je ne sais pas encore.
merci pour votre aide
Salut  !
!
a) ok
b) pour les ions simples ça correspond à la charge
c) ok
d) un potentiel c'est une tension
e) tu obtiens la fem en soustrayant la tension de l'électrode de droite à celle de gauche
f) ok pour le début, c'est bien pour les puissances
g) bien supposé
je suis désolée mais je n ai toujours pas compris pour la b) (le degrés d 'oxydation).
et sinon pour la d) ca donne quoi l expression du potentiel? est ce que ça serait ça : Ecathode = E(Cu2+/Cu) + 0,059/2 log(Cu2+)
e) comment trouver la fem à l'équilibre? 
merci encore
non je ne connais pas la formule de Nernst :/
Si pour Cu2+ cest +2 alors pour Al3+ cest +3 ? par contre je ne vois pas ce que ca peut etre pour KNO3.
merci encore pour votre aide 
ah d'accord donc c'est un exo "expérimental". Je vais te donner le détail de la formule de Nernst
Soit un couple Ox/red  ox + ne- =
ox + ne- =  red
red
Eox/red = E°ox/red + 0,06/n log ([ox] /[red]
/[red] )
)
Tu as les potentiels standards fournis
Oui je pense avoir compris la formule. Ca donnerait donc E= EoCu2+/Cu + 0,06/2log(Cu2+/Cu) non? Et pour Al3+/Al Ca donnerait E = EoAl3+/Al + 0,06/3 log (Al3+/Al) ?
ah oui c'est vrai jai oublié les crochets pour les concentrations. merci
Pourriez vous m aider pour les autres degres d'oxydation? je connais seulement ceux de Cu2+ et Al3+ et je ne vois pas comment faire pour les autres :/
On pourrait le calculer mais je n'en vois pas l'intérêt, déjà que tu n'es pas censé savoir la formule de Nernst
Ca n'est quand même pas l'espèce qui a une importance capitale, seulement en tant que pont salin donc tu ne la retrouves pas dans les béchers
eh bien aucunes pour l instant car je ne sais pas comment trouver les concentrations de Cu2+, Cu, Al3+, Al :/
Ca doit etre lié aux (1M), (4M).. mais je ne sais pas à quoi cela correspond exactement? je n'ai jamais vu cette notation auparavant.
a moins que ca soit : ECu2+/Cu = E°Cu2+/Cu + 0,06/2 log (1) = 0,521 + 0,06/2 log(1) = 0,521 ?
dans ce cas on aurait aussi EAl3+/Al = -1,662 mais ça me parait bizarre.
Je te fais confiance pour les valeurs, les ordres de grandeur sont corrects  Par contre utilise moins de chiffres significatifs
Par contre utilise moins de chiffres significatifs
donc log(1) cest bon? c'est bien ce qu il fallait faire? 
Par contre je suis bloquée pour la fem à l'equilibre.
Pour la question g), tu peux je pense faire ça de manière plus qualitative, c'est à dire en terme de concentrations 
merci mais jen suis toujours à la question e) ^^
pour la fem à l'instant initial je trouve 2,18 mais je ne sais pas comment faire pour la trouver à l'équilibre
Attention une fem c'est le potentiel de droite moins celui de gauche, ça s'arrête là. C'est E° qui te donnent les valeurs des potentiels à l'équilibre, et tu les connais
jai peur de n'avoir pas très bien compris :/ je ne vois pas ce qu ils me demandent de faire alors en me disant de trouver la valeur de la fem a l equilibre.
Car pour trouver la valeur de la fem à l'etat initial il me suffisait de soustraire les valeurs que j'avais trouvé à la question précédente non?
Et je croyais que E° etait le potentiel à l'etat initial justement?
La fem ne se calcule que de cette manière et correspond à l'état d'équilibre.
Donc la formule que tu as appliqué convient largement
et en ce qui concerne l'etat initial alors? je ne vois pas pourquoi ils me posent cette question s il n y a pas de difference :/
Je pense que je me suis mal exprimée
A l'état initial tu soustrais les E°
A l'état d'équilibre tu appliques la formule de Nernst.
Donc la formule que tu as appliqué convient largement
Désolé si on s'est mal compris
ah ok d'accord je comprends mieux. 
Mais il reste tout de même un problème car avec la formule de Nerst je trouve les mêmes valeurs que les E° donnés :/
Salut, j'ai eu le même problème que toi, et je ne crois pas rendre le DM entier.. J'aimerais juste savoir tu rentres à LaSalle Beauvais?
Et bien on va se rencontrer mardi. Moi je rentre en Géologie. Personnellement, je suis un peu perdue..
effectivement.. Mais je pense que c'est les deuxiemes années qui font ça pour nous perturber.. Moi j'ai pas eu le temps de bien faire, j'ai vraiment pas eu de temps, j'ai du faire mon déménagement pask je viens pas de la métropole, j'espère vraiment qu'il n'y aura pas de probleme. Deja que ce qui nous ont demandé de faire autre que le DM -_- lol, limite abusé
ah bon bah tant mieux alors  merci
merci
pour la f) on a k = [Al3+]² / [cu2+]^3 , c'est à dire k = 1 mais je ne le déduis pas de la question précédente.Or, ils disent : "en déduire.."
pour la conclusion, je ne connais pas Qri donc je ne peux pas dire que k est superieur à Qri, et je ne vois pas ce que je pourrai dire d autre :/
et sinon on ne peut pas tout simplement dire que l'aluminium ne fait tout simplement rien dans l'eau car il est protégé par une couche étanche d'oxyde d'aluminium Al2O3 transparente et adhérente et que par conséquent la pile ne marchera pas si on essaie de la réaliser en pratique ?
tu peux également, je pense que c'est une réponse rigoureuse et qui prouve que tu ne résous pas les questions sans lever la tête du guidon
bon je pense que je vais mettre ca alors parce que je ne vois pas tres bien ce que je pourrai dire d autre 
et pour le facteur limitant ya t il quelque chose de particulier à dire?


 (je suis de l'ensg nancy).
(je suis de l'ensg nancy).

