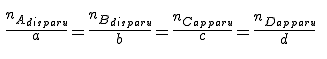Inscription / Connexion Nouveau Sujet
avancement maximal, final et taux d'avancement final
Bonjour,
Je me retrouve coincée sur deux questions,
Je vous expose le problème ci-dessous et vous remercie par avance de votre aide.
L'acide perchlorique a pour formule HClO₄. On prélève 20 mL de cet acide de concentration massique t = 0,798 g.L-1
1. Quelle est la concentration molaire de cette solution ?
Concentration molaire : C
Masse molaire = M(H)+M(Cl)+4M(O)
= 1 + 35,5 + 4x16
= 100,5 g.mol
Cm = m / v
0,798 = m / 0,020
0,798 = 0,01596 / 0,020
C = n / v
n = m / M
n = 0,01596 / 100,5 = 0,00016
C = 0,00016 / 0,020 = 0,008
2. On mesure un pH de 2,10.
A. Écrire l'équation de la réaction entre l'acide et l'eau
HCLO₄ + H₂O -> CLO₄⁻ + H₃O⁺
B. Calculer l'avancement maximal

....................HCLO₄............H₂O........CLO₄⁻..........H₃O⁺
Etat initial......n(HCLO₄).........n(H₂O).....n(CLO₄⁻).......n(H₃O⁺)
En cours de.....Cxv = 0,00016...Excès
transformation.0,008x0,020.....0,00016.......0...........0
Etat final........CxV- Xéq........Excès........Xéq.........Xéq
...................0,00016 - Xéq...0,00016–Xéq
PH = -log(C)
2,1 = -log (0,008)
-log (0,008) ≈ 2,0969
 :?
:? :?
:?
C. Déterminer l'avancement final et le taux d'avancement final
Je suis complètement perdue, aucune piste, rien ..  :?
:?
D. La réaction est-elle totale ?
si Xf=Xmax = réaction totale
si acide fort = réaction avec l'eau totale
Merci de votre patience et de votre aide.
Cordialement,
Princess 
Edit Coll : forum modifié
salut  !
!
1) sans unité un résultat ne veut rien dire. En outre il faut que tu m'expliques ça
0,798 = m / 0,020
0,798 = 0,01596 / 0,020

Alors,
la concentration massique :
Cm = m / v
Cm = 0,01596 / 0,020
Cm = 0,798 g/L
la concentration molaire :
C = n / v
C = 0,00016 / 0,020
C = 0,008 mol/L
est-ce correct ?
Mais tu n'explicites jamais n...
Il y a une relation bcp + simple :
tu sais que Cm = m/V or m = n*M
Tu en déduis que Cm = C*M
Ne vous excusez pas je fais juste des exercices pour me remettre à niveau !!
n représente la quantité de matière en mol ?
Si Cm = m / V or m = n * M
Alors Cm = C * M
Ce qui donnerai 0,798 g/L = 0,008 mol/L * 100,5 g.mol
Or 0.008 * 100.5 = 0.804 ..
Une fois cela résolu, ça va m'aider à répondre aux autres questions où je peine j'imagine mais je ne vois pas comment.
Merci de votre patience !!!! 
en fait Cm = m/V = (n*M)/V = C*M donc C = Cm/V
D'où C = 0,798/100,5 = 7,94.10-3 mol/L
C'est ok, tu comprends ce que j'ai fait ?
aaah oui tout s'éclaircit ! Merci 
ainsi que pour le tableau d'avancement sachant qu'il faut calculer C * V
C * V = 7,94*10[-3 * 0,020 = 0,00016 mol/L
....................HCLO₄..................H₂O...........CLO₄⁻..........H₃O⁺
Etat initial......n(HCLO₄)...............n(H₂O)........n(CLO₄⁻).......n(H₃O⁺)
En cours de.....Cxv=0,00016.........Excès
transformation...0,00016-X..........0,00016-X..........0...........0
Etat final........CxV- Xéq..............Excès.............0Xmax.........5Xmax
...................0,00016-0Xmax......0,00016-5Xmax
état final :
les ions HCLO₄ = réactif limitant car n(HCLO₄) = 0
n(HCLO₄) - Xmax = 0 => Xmax = n(HCLO₄) => Xmax = C*V
n(H₂O) - 5Xmax > 0 => n(H₂O) > 5Xmax => n(H₂O) > 5n(H₂O)
les ions H₂O = réactif limitant car n(H₂O) = 0
n(H₂O)-5Xmax = 0 => 5Xmax = n(H₂O) => Xmax = n(H₂O) / 5
n(HCLO₄)-Xmax > 0 => n(HCLO₄) > Xmax => n(HCLO₄) < 5n(HCLO₄)
est-ce que je m'en rapproche ?
pourrais-tu scanner ton tableau ou utiliser le deuxième icône en partant de la droite, sous le cadre de texte ?
HCLO₄ + H₂O => CLO₄⁻ + H₃O⁺
on a 0₄ + 0₄- ce qui donne 00
on a H₂ + H₃ ce qui donne H5
non ? d'où la multiplication par 5
Mon tableau d'avancement :
| HCLO₄ | H₂O | CLO₄⁻ | H₃O⁺ | |
| Etat initial | n(HCLO₄) | n(H₂O) | n(CLO₄⁻) | n(H₃O⁺) |
| En cours de transformation | Cxv=0,00016 0,00016-X | Excès 0,00016-X | 0 | 0 |
| Etat final | CxV- Xéq 0,00016-0Xmax | Excès 0,00016-5Xmax | 0Xmax | 5Xmax |
Non non ton équation est équilibrée, tu n'as pas de nombres stoechiométriques autres que 1
Or ce que tu écris là c'est comme si tu avais 5 molécules d'eau
Donc dans mon tableau j'enlève les 5 ?
Ce qui donne :
| HCLO₄ | H₂O | CLO₄⁻ | H₃O⁺ | |
| Etat initial | n(HCLO₄) | n(H₂O) | n(CLO₄⁻) | n(H₃O⁺) |
| En cours de transformation | 0,00016-X | 0,00016-X | 0 | 0 |
| Etat final | 0,00016-Xmax | 0,00016-Xmax | Xmax | Xmax |
Quel est l'avancement maximal ? 0,00016-Xmax ?
Et l'avancement final est Xmax ?
Etat final :
les ions HCLO₄ = réactif limitant car n(HCLO₄) = 0
n(HCLO₄) - Xmax = 0 => Xmax = n(HCLO₄) => Xmax = C*V
n(H₂O) - Xmax = 0 => Xmax = n(H₂O)
les ions H₂O = réactif limitant car n(H₂O) = 0
n(H₂O)-Xmax = 0 => Xmax = n(H₂O) => Xmax = n(H₂O)
n(HCLO₄)-Xmax = 0 => Xmax = n(HCLO₄)
xmax c'est par définition l'avancement maximal
La flotte va être en excès donc pas besoin de t'en préoccuper, xmax = n(HClO4)
Ah d'accord merci 
Le calcul est donc :
les ions HCLO₄ = réactif limitant car n(HCLO₄) = 0
n(HCLO₄) - Xmax = 0 => Xmax = n(HCLO₄)
Merci de votre patience et de votre aide encore une fois!
Comment calculer le taux d'avancement final maintenant, svp ?
Je ne suis pas vraiment convaincue que tu aies compris le principe malgré ce que tu écris. Tu as déjà vu les tableaux d'avancement en cours ? On t'a appris ça comment ?
Nan pas encore, je fais des exercices dans les manuels d'été pour la classe de Terminale à la rentrée. Je pioche un peu dans ce que je trouve comme aide sur le manuel ou sur internet sans vraiment de réponses..
AAAAAAAh ok
Pour la réaction : aA + bB ==> cC + dD
| Avancement | aA | bB | cC | dD |
| t=0 | Ao | Bo | 0 | 0 |
| x | Ao-ax | Bo-bx | Co+cx | Do+dx |
| xmax | Ao-axmax | Bo-bxmax | Co+cxmax | Do+dxmax |
Est-ce-que tu comprends ce tableau ?
J'ai peur de paraître bête, mais il n'y a que les idiots qui ne posent pas de questions!! 
Pourquoi il y a deux lettres? C'est ça que je ne cerne pas, car aA ne peut pas représenter que HCLO4 ..
a * A + b * B = c * C + d * D
a * HCLO₄+ b * H₂O = c * CLO4⁻ + d * H₃O⁺
A0 - ax = HCLO₄au temps 0 - ax = 0,00016 - ax ?
HCLO₄et H₂O au temps 0 ont bien pour valeur 0,00016 ?
C = 0,798/100,5 = 7,94.10-3 mol/L serait-il une des deux réponses? avancement maximal ou final ?
Les petites lettres sont les coefficients stoechiométriques et les grandes les espèces chimiques.
Contente toi de les identifier d'abord, on passera aux valeurs numériques ensuite
Vous m'aviez dis qu'ici il n'y a pas d'autres nombres stoechiometriques que 1 puisque l'équation est équilibrée, alors :
aA représente 1HCLO4
bB correspond à 1H2O
cC s'assimile à 1CLO4-
dD s'apparente à 1H3O+
Mais je dois me tromper quelque part car sinon on avance pas dans la résolution des questions..
les coefficients stchiométriques dépendent des signes « - » « + » desfois.. peut être que la différence est là..
aA : 1HCLO4
bB : 1H2O
cC : CLO4-
dD : 2H3O+
Le bB ne peut pas avoir la même valeur que aA comme je le disais plus haut
Oui c'est bien ça. Non les coeff ne dépendent pas des signes, tu ne peux pas avoir -HClO4 par exemple
Pour la réaction : aA + bB ---> cC + dD
[img1]
Sachant que les substances ne sont pas réellement apparues et n'ont pas non plus disparu : elles se sont transformées (principe de conservation de la matière de Lavoisier)
Tu suis toujours ?
Maintenant écris ça avec tes espèces chimiques
Donc je pars sur :
aA : 1HCLO4
bB : 1H2O
cC : CLO4-
dD : 2H3O+
mais en oubliant que c'est dû aux signes.
La loi de conservation de masse de Lavoisier signifie qu'on aura toujours les mêmes éléments chimiques avant et après la transformation. Aucun élément n'apparaît, aucun ne disparaît. Avant et Après transformation il y a toujours la même masse. Ca ok 
nAdisparu / a = nBdisparu / b = nCapparu / c = nDapparu / d
nHCLO4 / 1 = n H2O / 1 = nCLO4- = n H3O+ / 2
0.00016 / 1 = H2O / 1 = CLO4- = H3O+ / 2
ça ne peut pas être ça car ça voudrait dire que H2O et CLO4- ont la même valeur que HCLO4, soit 0,00016 et que H3O+ = 2*HCLO4, soit 2*0.00016
D'accord, car je pensais que vous validiez le 2ème des deux propositions que je vous avez faites.
Donc tout est égal à 0,00016 ?
D'accord merci 
Donc comme donnée on a :
 nHClO4 = nH2O = nClO4- = nH3O+ = 1,6.10-3 mol
nHClO4 = nH2O = nClO4- = nH3O+ = 1,6.10-3 mol
 t = 0,798 g.L-1
t = 0,798 g.L-1
 C = 0,798/100,5 = 7,94.10-3 mol/L
C = 0,798/100,5 = 7,94.10-3 mol/L
 V = 20mL
V = 20mL
 Masse molaire = 100,5 g.mol
Masse molaire = 100,5 g.mol
 l'équation HCLO₄ + H₂O -> CLO₄⁻ + H₃O⁺ est équilibrée
l'équation HCLO₄ + H₂O -> CLO₄⁻ + H₃O⁺ est équilibrée
 PH = -log(C)
PH = -log(C)
2,1 = -log (0,008)
-log (0,008) ≈ 2,0969
Même si on n'en est pas à là j'ai quand même trouvé que le calcul du taux d'avancement : T = Xf / Xmax
Xf se détermine grâce au pH
et qu'il faudrait peut - être partir sur quelque chose comme pH = -log[H3O+]
J'ai aussi essayé des calculs, -log7,94*10-3 = 2.1 soit la valeur du pH
Mais je n'arrive pas avec toutes ces données à faire la relation avec l'avancement maximal et final.
Je me progeterai pour l'avancement final sur 1,6.10-3 mol
déjà à la B on ne te demande que l'avancement maximal donc tiens t-en là
C) tu as répondu à cette question de manière littérale.
D) Maintenant effectivement tu utilises le pH. Et tu as dit dans ton message initial comment tu devais faire
D'accord
donc pour la b :
L'état initial est :
nHClO4 = nH2O = nClO4- = nH3O+ = 1,6.10-3 mol
Calcul Xmax :
1,6.10-3 - Xmax = 0
Xmax = 1,6.10-3
Est- ce que ça se rapprocherai de ça ?
B.
l'avancement maximal est :
Calcul Xmax :
1,6.10-3 - Xmax = 0
Xmax = 1,6.10-3
C.
pH = -log[H3O+]
-log7,94*10-3 = 2.1
Donc l'avancement final est 7,94*10-3 ce qui correspondrait donc à [H3O+] et [CLO4-]
De là on pourrait calculer le taux d'avancement final :
Xf / Xmax
= 7,94*10-3 / 1,6.10-3
= 4,9625
 5%
5%
D.
Mais 0 < T < 1
Si T = 0 alors la réaction n'a pas lieu
Si T = 1 alors la réaction est totale
Or T = 5, ici
Mais l'acide fort est [H3O+] alors la réaction est totale
21h42 : n'oublie pas l'unité de xmax ! Il ne faut jamais oublier les unités.
C) pareil, n'oublie pas les unités
D) oui à exprimer un peu mieux mais c'est correct
au passage d'ailleurs, c'est parce-que ta réaction est totale que tu eux dire que tu as un acide fort 

Aaaah !!!! merci beaucoup de votre aide !!!
Les unités :
B. Xmax est en mol
C. 2,1 mol.L-1
D. T pas d'unité ou en % . Xf et Xmax en mol
Je vous remercie énormément !
Bonne continuation,
Cordialement,
Princess