Inscription / Connexion Nouveau Sujet
Acide forts
Bonsoir !
En continuant la compréhension de mon cours, je suis rapidement tombé sur une notion me paraissant assez floue.
La définition dit qu'un acide est dit fort si sa réaction sur l'eau est quasi totale.
En d'autre terme, l'acide est totalement consommé.
Pour traduire ça, il est aussi dit que l'avancement final = l'avancement maximal
De ce fait, l'équation acido basique d'un acide fort est noté comme cela :
AH + B => A- + B+
Il est dit que la réaction inverse ne s'effectue pas.
Donc A- + B+ => AH + B est impossible, c'est bien ça ?
De plus, cela a permit de dresser un tableau d'avancement
Voici donc mes incompréhensions :
1) Qu'est ce qui différencie x max de x f ??
2) Dans le tableau d'avancement, pourquoi le nombre de mol d NO3- et d H30+ sont égaux aux nombre de mol total de HNO3?? Je ne sais pas si la question est bien tourné mais je ne vois pas comment il peut y avoir 2 fois plus de quantité de matière produit à partir d'une quantité de matière spécifique? Pourquoi à partir de n on produit 2n?
J'espère que ma seconde question est assez clair :s
Ca sera tout pour ce soir 
ps : Je ne sais pas si j'ai le droit de poster l'image du tableau d'avancement étant donné qu'il y a du texte?
Merci d'avance pour vos réponses !
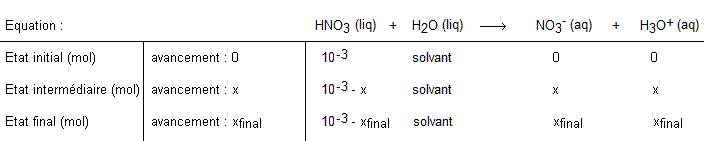
J'ai décidé de faire un exercice afin de mieux comprendre les notions.
Voici l'énoncé (J'ai hésité à créer un autre topic mais vu que l'exercice concerne les acides je ne pense pas que cela soit utile)
Une solution d'acide chlorhydrique est obtenu en faisant réagir du chlorure d'hydrogène (HCl) et de l'eau (H2O) selon l'équation suivante :
HCL + H2O => CL- + H3O+
le pH d'une solution d'acide chlorhydrique V = 50,0 mL et de concentration
C = 2,0*10^-3 mol .L^-1 vaut 2,70
1) Établir le tableau d'avancement de la réaction
2) Déterminer l'avancement maximal x max
3) Calculer l'avancement final xf de la réaction
4) Comparer xf et xmax
J'ai donc commencé par calculer la quantité de matière :
50mL = 50*10^-3L
n = (50*10^-3)(2*10^-3)=10^-4 mol
Je viens de calculer la quantité de matière d'une solution d'acide chlorhydrique mais comment interpréter ce résultat afin de l'utiliser dans le tableau d'avancement ?
Car le nombre de mol concerne la solution d'acide chlorhydrique donc Cl- + H30+.
Comment peut on savoir dans quel proportion est réparti le nombre de mol dans chacun des deux produits? Et concernant les réactifs??
Merci pour vos futur réponses ! 
Bonjour.
dans quelle proportion est réparti le nombre de mol dans chacun des deux produits?
D'après l'équation de la réaction : HCl + H2O = H3O+ + Cl-
Décryptage : 1 HCl + H2O = 1 H3O+ + 1 Cl-
Traduction : La mise en solution de 1 mol HCl permet d'obtenir, si la réaction est totale, 1 mol H3O+ et 1 mol Cl- ; ne cherchez pas de complications, il n'y en a pas.
D'accord pour votre calcul de la quantité de chlorure d'hydrogène initialement mis en solution ; c'est bien
L'eau étant en excès, vous pouvez déduire l'avancement maximal en utilisant le tableau d'avancement.
A partir de la valeur du pH mesuré, calculez la concentration effective en ion
Une fois
A vous.
Bonsoir !
J'ai appliqué ce que vous m'avez conseillé, voici ce que j'ai fait :
En faisant le tableau d'avancement, j'en ai déduit que x max = 1*10^-4 mol
Puis j'ai calculé la concentration en ion H30+ :
[H30+]= 10^-2,7=2*10^-3 mol.L^-1
J'ai calculé nf(H30+) :
nf (H30+) = (2*10^-3)(50*10^-3) = 1*10^-4 mol
donc xf=1*10^-4 mol
comme xmax=xf, la réaction est total.
Cependant, il y a quelques trucs que je n'ai pas compris :
La première quantité de matière trouvé par la concentration de la solution et le volume, vous dite qu'il s'agit de de la quantité de matière d'HCl initialement mis en solution.
Pourtant, selon l'énoncé, ces valeurs concernent la solution d'acide chlorhydrique donc Cl- + H30+.
Dois je en déduire que dans une solution, la quantité de matière des produits est la même que celle des réactifs ?
Merci encore pour vos explications 



