Inscription / Connexion Nouveau Sujet
Acide/Base
Bonjour,
Je coince sur un exercice
Le suc gastrique est un acide très fort du à la présence d'acide chlorhydrique. Certains anti-acide aident à faire remonter le pH intra gastrique.
Un anti acide est composé de CaCO3 et MgCO3
A 100mL d'acide gastrique ayant un ph de 2,0, sont ajoutées 0,225 mmol de CaCo3 et 0,250 mmol de MgCo3.
Un gaz est formé. Quelle est la valeur du pH atteint à l'issue de cette réaction ?
Alors j'ai commencé par écrire l'équation en cherchant de ce fait la concentration en H30+ et en considérant qu'il s'agissait d'un acide faible donc que pH = pka/2 - 0,5 *log Ca mais ça ne donne rien du tout ...
Merci pour votre aide
Bonjour
Avant de chercher à appliquer une formule toute faite, essaie un peu de réfléchir à la situation :
Quelle est l'équation bilan de la réaction ?
Ensuite, tu peux remplir un tableau d'avancement et trouver les quantités restantes après réaction...
Je te laisse réfléchir
Il est préférable d'écrire l'équation bilan sans écrire les ions spectateurs. HCl est le chlorure d'hydrogène : c'est un gaz (acide fort) qui, en présence d'eau produit des ions Cl- (ions spectateurs) et des ions oxonium H3O+. Ce sont ces ions oxonium qui réagissent sur les carbonates de calcium et de magnésium pour produire un dégagement de dioxyde de carbone CO2.
oui et comme la concentration en H3O+ = Concentration en HCl car acide complètement dissocié dans l'eau
on a donc n H3O+ final= 7,73x 1O^-3
mais je ne vois toujours pas comment calculer le pH..
on considère bien que c'est une solution finale plutôt basique ?
Et si tu commençais par écrire proprement l'équation bilan puis remplissais un tableau d'avancement ?
j'essaye mais je ne comprend pas ...
Je précise que je suis en reprise d'études donc ce sont des notions très lointaines que j'ai du mal à réintégrer ...
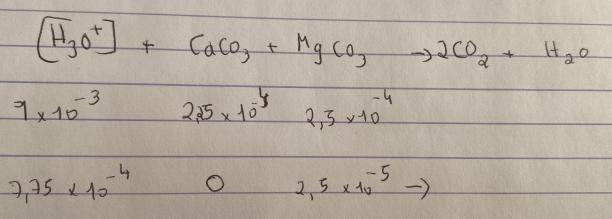
Encore une fois : Les molécules HCl n'existent pas dans l'acide chlorhydrique : [HCl]=0 !!!
En revanche, tu as bien [H30+]=10-2mol/L avant réaction. Connaissant le volume de solution, tu peux ainsi connaître la quantité initiale d'ions oxonium.
Tu postes au niveau terminale sans savoir équilibrer une équation bilan... Je te fournis l'équation pour la réaction de l'acide sur le carbonate de calcium. Je te laisses équilibrer celle sur le carbonate de magnésium puis calculer la quantité d'ions oxonium restante sachant que les deux solides réagissent de façon complète.
2H3O+ (aq) + CaCO3(s)  CO2(g)+Ca2+(aq)+3H2O
CO2(g)+Ca2+(aq)+3H2O
L'éuation bilan doit être conforme à la conservation des éléments chimiques et à la conservation des charges électriques.
Merci beaucoup.
Mais comment peut-on savoir quels réactifs réagissent avec quels réactifs ? Pourquoi MgCo3 n'apparait pas ?
Pas tout à fait d'accord avec ton "donc". En effet, la dernière équation bilan que tu écrit fait intervenir le même coefficient stchiométrique ("1") devant CaCO3 et MgCO3 ; cela supposerait donc l'égalité des quantités de CaCO3 et de MgCO3 qui réagissent ; ce qui est faux. Il faut donc faire deux tableaux d'avancement indépendants puis additionner les quantités d'ions oxonium disparues par les deux réactions.
Bonsoir à vous deux,
@ chacha1995 : merci de respecter la règle de recopie des pistes de réflexion, celles-ci ont été supprimées
super merci beaucoup 
Je pense du coup avoir trouvé la bonne réponse =)
Merci beaucoup pour ton Aide !!!
Oh pardon !!!! je n'avais vu que la réponse
je ne savais pas qu'on ne pouvait pas mettre nos réflexions en photo !!
désolée
du coup : j'ai ajouté les quantités de H3O+ des deux équations pour au final trouver la concentration et donc le pH !!! 
Non ! Je pense que tu n'as pas pris en compte le fait que la quantité d'ions oxonium réagissant est le double de la quantité de carbonate disparue. Observe bien les coefficients stchiométriques des équations bilans.
Décidément , j'aurais mis le temps mais oui je n'avais pas enlevé 2n à chaque fois pour les 2 expressions..
Je trouve donc Concentration = 5x10^-4 mol/L et pH=3,3 


 ...
...
