Inscription / Connexion Nouveau Sujet
confomations stable et pas stable
Bonsoir !
je revois un peu mes activités mais il y a quelque chose que je n'arrive pas à saisir.
Cela concerne les conformations stable et pas stable. Ce que j'ai compris c'est que lorsque la conformation est stable , l'enérgie de rotation de la molécule est plus faible . Mais après.......  (on nous donnait aussi les conformations de l'éthane )
(on nous donnait aussi les conformations de l'éthane )
On me demande de représenter les conformations extrêmes du 1,2 dichloroéthane et du butane.
Mais je ne me rappelle plus du raisonnement fait en classe et j'arrive pas à le faire
Si vous pouvez m'expliquer parce que j'y arrive vraiment pas ...
Merci d'avance pour vos réponses  j'espères que vous m'aiderez, bonne soirée !
j'espères que vous m'aiderez, bonne soirée !
salut
Les conformations sont des positions d'équilibre pour la molécule. Cependant, certains de ces équilibres sont stables et d'autres instables !
Comme tu le vois sur le dessin, les positions à droite et à gauche sont des conformations de basse énergie potentielle (donc stable). en revanche la conformation du milieu est un équilibre instable : une moindre pichenette peut le faire basculer à droite ou à gauche
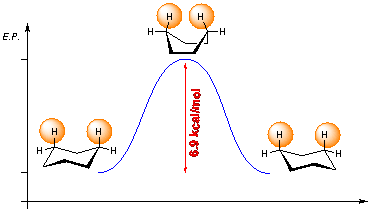
merci de ta réponse =) je vois mieux mais comment représenter le 1, 2 dichloroéthane et le butane alors ??
je ne suis pas expert en chimie, par contre si je tappe "butane conformation" dans google images, je tombe sur ça. T'en penses quoi ?
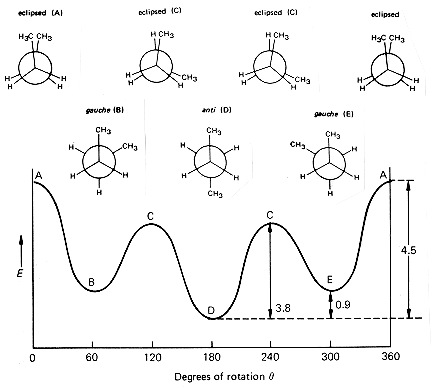
comment je represente ces molecules en conformation stable et en conformation instable, justement je ne sais pas comment on fait .... 


