Inscription / Connexion Nouveau Sujet
Vérification pourcentage massique de nitrate d'ammonium
Bonjour,
Je n'arrive pas à répondre à la question 3 de cet exercice dont voici l'énoncer :
On souhaite vérifier le pourcentage massique de nitrate d'ammonium NH4NO3 d'un engrais commercial.
Pour cela on dissout une masse m = 1,7g d'engrais dans de l'eau distillée pour obtenir V = 210 mL de solution. On prélève un volume VA = 30 mL de cette solution. On ajoute à cela un volume de 100mL d'eau distillée avant de procéder au titrage de la solution obtenue par une solution d'hydroxyde de sodium (Na+, HO-) de concentration C = 2,00 .10-1 mol.L-1.
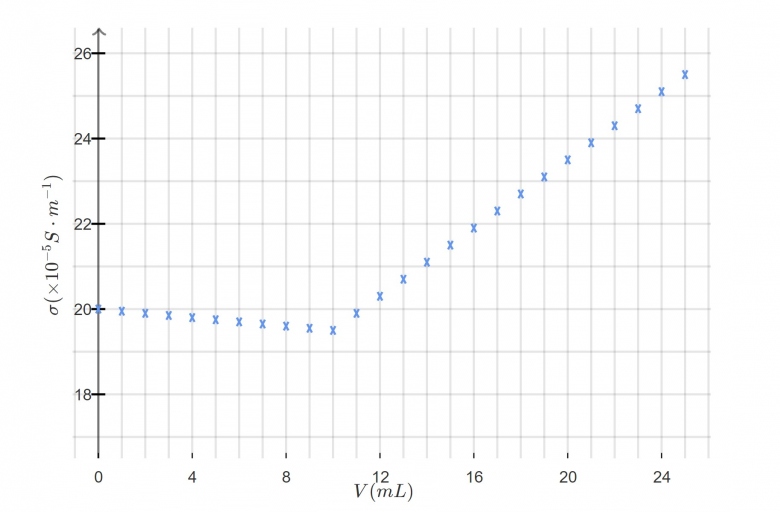
On obtient la courbe de titrage suivante : pièce jointe.
1) Déterminer le volume à l'équivalence Veq
2) En déduire la concentration CA des ions NH4+ dans le volume VA de solution.
3) Quel est le pourcentage massique de nitrate d'ammonium dans l'engrais testé ?Mes réponses :
1) On lit sur le graphe : Veq = 10 mL
2) On a la relation : CA . VA = CB . Veq
On trouve : CA = 8,00 .10-2 mol*L-1
3) On a un facteur de dilution de 130/30 = 4,3
On calcule Cinitial = 4,3 * CA = 3,5 .10-1 mol.L-1
On en déduit la masse m :
m = C*V*M
m = 3,5 .10-1*0,21*80
m = 5,82
ce qui est IMPOSSIBLE
Où ai-je fais une erreur ?
Merci pour vos réponses !
Bonsoir,
Question 1 :
Veq = 10mL : OK
Question 2 :
Relation CA * VA = CB * Veq : OK
Mais je ne retrouve pas ton résultat de CA = 8,00 . 10-2 mol/L
Merci de donner le détail de ton calcul numérique.
Ah oui en effet, je ne sais pas d'où sort ce 8,00 .10-2
Donc on a
CA = (CB*Veq)/VA
CA = (2,00 . 10-1 * 10 .10-3) / 30 .10-3
CA = 6,70 .10-2 mol.L-1
Et donc pour la 3e question est-ce que c'est la bonne démarche même si les résultats sont avec des valeurs différentes ?
Et donc pour la 3e question est-ce que c'est la bonne démarche même si les résultats sont avec des valeurs différentes ?
Non
Bien que tu n'aies pas pris la précaution de définir tes notations, ce que tu as appelé CA n'est rien d'autre que la concentration de la solution en ions NH4+
Ton résultat CA = 6,70.10-2 mol/L est correct. Toutefois pour la suite j'utiliserai plutôt le résultat non arrondi CA = (1/15) mol/L
La quantité de NH4+ présente dans V=210mL de solution est donc :
n(NH4+) = CA * V = (1/15) * 0,21 = 0,014 mol
Or tous les ions NH4+ proviennent du NH4NO3 introduit donc
n(NH4NO3) = n(NH4+) = 0,014 mol
Il te faut maintenant calculer la masse de NH4NO3 et la comparer à la masse m d'engrais laquelle renferme ce NH4NO3
Le résultat de cette comparaison te donnera le pourcentage massique de NH4NO3 contenu dans l'engrais.
Bonjour, merci pour votre réponse
J'ai trouvé le résultat :
t = 65,9%
Mais pourquoi on prend pas en compte la seconde étape de l'expérience qui consiste à rajouter 100 mL d'eau dans VA ? Il s'agit bien d'une dilution de facteur 4,3 qui est à prendre en compte non ?
C'est pour ça que je ne comprends pas pourquoi n(NH4NO3) = n(NH4+).
Merci pour votre aide !
Ajouter de l'eau avant le titrage ne modifie pas la quantité de matière de NH4+.
Cette dilution avant titrage est une nécessité expérimentale liée au protocole du titrage. Elle n'intervient pas dans le calcul.
Il en résulte que la concentration en ions NH4+ avant dilution est bien celle qui a été trouvée : CA = 1/15 mol/L
La quantité de matière en NH4+ dans 210 mL de solution est donc bien de 0,210 * (1/15) = 0,014 mol
Chaque ion NH4+ provient d'une entité de NH4NO3 donc
n(NH4NO3) = 0,014 mol
La masse molaire de NH4NO3 est M = 80g/mol
On en déduit que la masse de NH4NO3 est de 80 * 0,014 = 1,12g
1,7g d'engrais renferment 1,12g de NH4NO3 soit un pourcentage de 1,12 / 1,7 = 0,659 = 65,9%
Ton résultat est correct mais compte tenu de la précision des données il est préférable de l'arrondir à 66%


