Inscription / Connexion Nouveau Sujet
Un ion spectateur
Bonjour,
Est-ce que quelqu'un saurait si la conductivité d'une solution au cours du temps dépend de lamda d'un ion spectateur même si la conductivité initiale dépend de celui-ci svp? merci
Par définition, un ion spectateur n'intervient pas la réaction.
S'il est présent avant la réaction ( de concentration c ) il le sera aussi à la fin ( de concentration c)
D'où, au début de la réaction
 = ... ... + c
= ... ... + c ion
ion
En fin de réaction :
 = ... + ... + c
= ... + ... + c ion
ion
Au cours du temps, l'évolution de la condutivité d'une solution au cours du temps ne dépend pas de la conductivité d'un ion spectateur.
Mes explications ne sont peut être très claire, mais la réponse, l'est (en principe)

Ayoub.
Bonjour,
Je reprends ce topic : tout le monde s'accorde pour dire que les ions spectateurs n'entrent pas en jeu dans une réaction mais dans mon cours il est écrit :
"cas d'addition de solution d'hydroxyde de sodium Na+ (aqu) + HO-( aq) à une solution d'acide chlorhydrique H3O+(aq) + Cl-(aq)
(...) une partie des ions oxoniums H3O+ est remplacée par des ions N'a+ (aq) en même quantité.
La conductivité des ions Na+ étant inférieure à celle des ions oxonium, cela explique la diminution de la conductance."
J'aurais tendance à penser qu'il faut plutôt comprendre que c'est parce que la quantité des ions oxonium baisse qu'il y baisse de conductance de la solution finale , les ions sodium n'ayant rien a voir, ou suis-je passée à coté d'une subtilité ?
Merci d'avance
La conductivité d'une solution est une fonction de la concentration de toutes les espèces chargées en solution...
---------------------------
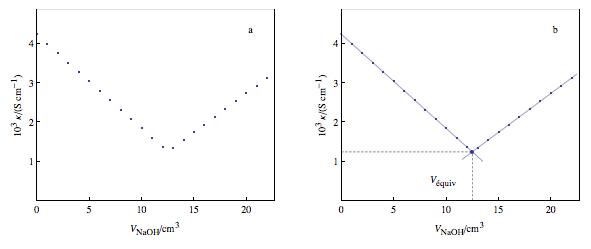
Dans le cas du dosage d'une solution acide d'HCl par une solution de soude NaOH l'évolution de la conductivité à volume constant est de la forme de première figure jointe. Avant l'équivalence les ions ions H3O^(+) sont remplacés quantitativement par des ions Na^(+). La conductivité des ions Na^(+) étant plus faible que celle des ions H3O+ la conductivité diminue.
Après l'équivalence les ions OH^(-) étant en excès, la conductivité re-augmente
----------------------------
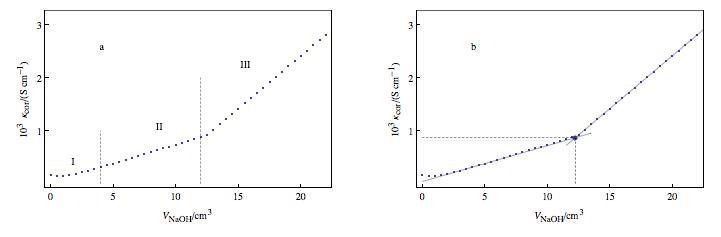
Dans le cas du dosage d'une solution d'acide faible AH (non totalement dissocié) par une solution de soude NaOH l'évolution de la conductivité à volume constant est de la forme de la seconde figure jointe. Au début du dosage le graphe d'évolution des concentrations montre que dans les conditions initiales de l'expérience l'acide AH est partiellement dissocié. Au début du dosage les ions H3O^(+) sont neutralisés et remplacés par les ions A^(-) et Na^(+). La valeur de la conductivité équivalente limite de l'ion H3O^(+) étant très supérieure à la somme des conductivités équivalentes limites des espèces A^(-) et Na^(+), la conductivité de la solution diminue. Cette décroissance de la conductivité en début de dosage (début partie partie I) est d'autant plus importante que la concentration de l'acide en soluté apporté est faible.
La conductivité augmente par contre lorsque la variation de concentration de l'ion H3O^(+) devient négligeable devant celle de AH. L'espèce AH neutralisée (qui ne conduit pas le courant) est remplacée par A^(-) et Na^(+). L'augmentation de conductivité, due à l'apparition de ces espèces, l'emporte sur sa diminution produite par la neutralisation de l'ion H3O^(+) et la conductivité globale augmente jusqu'au volume d'équivalence (partie II). Après ce volume, la concentration de l'ion A^(-) est pratiquement constante. Les concentrations des espèces OH^(-) et Na^(+) augmentent (III). La conductivité équivalente limite de l'ion OH^(-) étant très supérieure à celle de l'ion A^(-) , la variation de la conductivité devient plus rapide après l'équivalence et il y a donc rupture de pente du graphe de pour la valeur de Veq.
Merci pour ta réponse et je sens une subtilité que je ne saisis pas encore.
L'équation de cette réaction est H30+(aq) + HO-(aq) --> 2H20(l)
Donc pourquoi dit-on que les ions Na+ remplacent les ions H3O+ puisque ces 2 espèces n'interagissent pas ?
En fait l'équation de cette réaction est
H30^(+)+Cl^(-) + Na^(+)+OH^(-) --> 2H20 +Cl^(-) + Na^(+)
Les ions Na^(+) et Cl^(-) sont dit "indifférents" ou "spectateurs" et on l'écrit donc conventionnellement plus simplement
H30^(+)+OH^(-) --> 2H20
La disparition d'un ion H3O^(+) et d'un ion OH^(-) s'accompagne de l'apparition d'un ion Na^(+) (électroneutralité de la solution) c'est pourquoi on dit, lors de ce dosage et avant l'équivalence, que tout se passe comme si l'on remplaçait les ions H3O^(+) par des ions Na^(+).


