Inscription / Connexion Nouveau Sujet
Trouver le pH
Bonjour,
Voilà, j'étais entrain de refaire quelques exercices sur le pH et j'ai bloqué sur l'une d'elle.
L'énoncé :
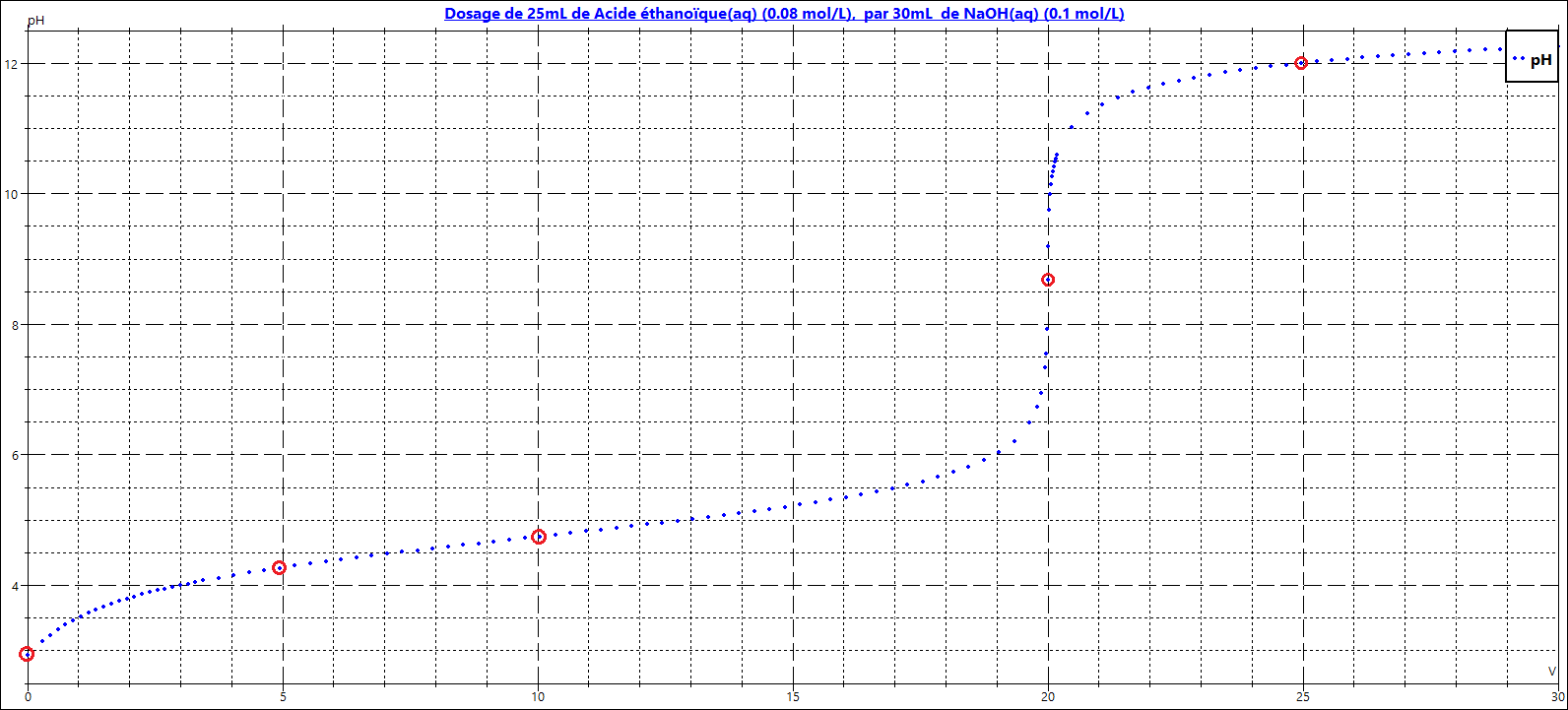
On réalise le titrage de 25 mL de CH3COOH 0,08 M par du NaOH 0,10 M.
a. Quel est le pH de la solution d'acide avant tout titrage ?
b.Quel sera le pH de la solution obtenue lorsqu'on aura ajouté :
i. 5 mL de NaOH
ii. 10 mL de NaOH
iii. 20 mL de NaOH
iv. 25 mL de NaOH
Mon raisonnement :
J'ai réussi à trouver le pH pour la question a en appliquant la formule pH=1/2*pKa-1/2log(Ca) mais je n'ai pas obtenu les bonnes réponses pour la b.
Pour la i. , j'ai d'abord calculé le nombre de mol qui réagissaient grâce à la formule C*v=n, j'ai obtenu 5*10^-4. J'ai ensuite fait la différence des moles entre celle du CH3COOH et du NaOH : 2*10^-3 - 5*10^-4 =1.5*10^-3
Ainsi, je sais que c'est l'acide acétique qui est en excès lorsque j'ajoute 5ml de NaOH.
Je cherche la concentration totale : C=(1.5*10^-3)/(25*10-3+5*10^-3)=0.05
Pour finir j'applique la formule du pH d'un acide faible (car c'est lui qui est en excès) donc ça me donne pH=1/2pKa-1/2log(Ca)=3.02
Pourtant, la réponse correcte est de 4.26
Pouvez-m'éclairer?
Merci à ceux qui prendront le temps de me lire et de me répondre 
Je pense finalement avoir trouvé mon erreur :
CH3COOH + NaOH ->CH3COONA +H2O
la formule pour trouver le pH est fausse car il s'agit en fait d'un mélange tampon, il suffit alors de trouver la concentration finale de CH3COOH et celle de CH3COO- et j'applique ensuite la formule ph=pKa+log([CH3COO-]/[CH3COOH])
Pour V= 0mL
C'est le pH d'une solution d'acide faible.
Pour V = 5mL :
Tu as eu la bonne idée, c'est une solution tampon.
Pour V = 10 mL :
On est à la 1/2 équivalence donc ......
Pour V = 20 mL
On est à l'équivalence, le pH est celui d'une solution de la base conjuguée de l'acide éthanoïque.
Pour V = 25mL
A partir de V=20 mL les ions HO- ne réagissent plus et s'accumulent en solution. Le pH est celui d'une solution de base forte.
Oui bien sûr.
Donc pour le i, j'ai déterminer le nbr de moles de NaOH,qui est égale à 5*10^-4 ( en appliquant la formule : n=C*V). Ensuite, j'ai fait mon schéma bilan, je remarque que la totalité de mon NaOH réagit, il y a seulement le CH3COOH qui est excès(1.5*10^-3 moles) et bien sûr la formation de sa base conjuguée CH3COO- (5*10^-4 moles). J'obtiens [CH3COOH] : 0.05 M et [CH3COO-] : 0.017 M. J'applique ensuite la formule pH =pKa+log(Cb/Ca) en remplaçant par mes valeurs, j'obtiens un pH de 4.27.
Pour le ii, je fais pareil que pour le i pour déterminer le nbr de moles (1*10^-3). Je fais mon schéma bilan, mon NaOH est également complètement consommé, j'ai 1*10^-3 de CH3COOH en excès et la même chose pour le CH3COO-. Sans calculer la concentration(car elles vont s'annuler étant donné qu'il y a le même nombre de moles). J'applique la même formule du pH qu'au dessus : ph=4.75+log(1), ce qui me donne un pH de 4.75
Pour le iii, idem je cherche le nbr de moles de NaOH(2*10^-3). Je fais le schéma bilan et cette fois-ci mes réactifs sont consommés complètement, il y a la formation du CH3COO- (2*10^-3 moles). Je trouve ma concentration qui est de 0,04. Sachant que c'est une base faible, j'applique la formule du pH=7+1/2pKa+1/2log(Cb) = 8.69
Pour le iv, idem je cherche le nbr de moles de NaOH (2.5*10^-3 moles). Je refais le schéma bilan, je remarque que cette fois-ci, c'est mon NaOH qui est en excès(5*10^-4 moles), je trouve ma concentration totale (0.01). J'applique la formule du pH pour une base forte : pH=14+log(Cb) =12
Voilà j'espère que ça pourrai aider d'autres personnes