Inscription / Connexion Nouveau Sujet
trinitrotoluène
Bonjour,
Une quantité de trinitrotoluène (TNT) de formule semi développée ci dessous est séparée par l'action contrôlée de l'acide nitrique (HNO3) sur 20kg de Toluène.
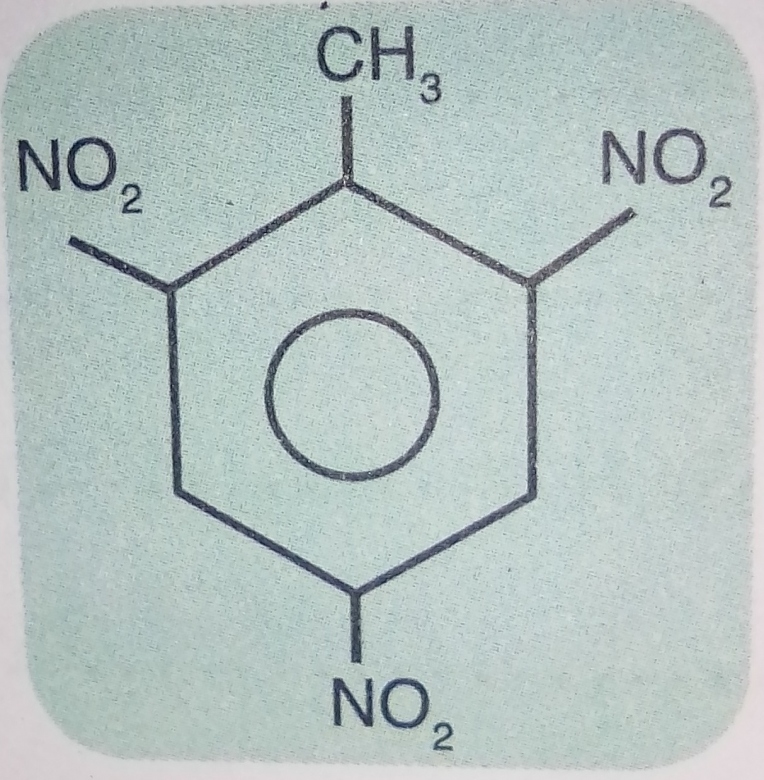
. La réaction chimique se déroule avec beaucoup de précautions , car le TNT est un explosif puissant .Le rendement de cette réaction chimique est de 70% .
1) Écrire l'équation bilan de la réaction chimique qui permet d'obtenir le TNT.
2) Déterminer la masse de TNT obtenue.
L'énoncé donne les noms des deux réactifs et le nom d'un des produits.
L'autre produit de la réaction est très facile à trouver compte tenu de la conservation des éléments chimiques.
Non.
La première chose à faire est d'identifier correctement ( nom et formule ) les deux réactifs et les deux produits.
L'énoncé donne les noms des deux réactifs :
- Le toluène dont tu as trouvé la formule : C7H8
- L'acide nitrique dont la formule figure dans l'énoncé et qui n'est pas NO2 comme tu as l'air de le penser.
L'énoncé donne aussi le nom et la formule (sous sa forme semi-développée) du trinitrotoluène qui est l'un des deux produits de la réaction.
L'énoncé ne donne ni le nom ni la formule du deuxième produit mais comme je l'ai déjà indiqué
(04-03-20 à 14:03) celui ci est très facile à trouver compte tenu de la conservation des éléments chimiques.
En résumé il te faut établir la liste suivante :
Réactif 1 : Le toluène C7H8
Réactif 2 : ..................................
Produit 1 : .................................
Produit 2 : .................................
Une fois cette liste établie tu pourras écrire et équilibrer l'équation-bilan de la réaction


