Inscription / Connexion Nouveau Sujet
TP étude Qualitative
Bonjour à tous , à toutes et bonnes vacances
je me suis aperçu que j'avais encore quelques difficultés avec les ions alors j'ai recherché plusieurs TP afin de m'entraîner
je vous propose donc cet énoncé (au cas ou vous voudriez bien m'aider))
l'hydrogénocarbonate de sodium est plus connu sous le nom de bicarbonate de sodium sa formule chimique est Na H CO3 (s)
le vinaigre est une solution aqueuse d'acide éthanoique et sa formule chimique est
a. caractérisation des substances chimiques
1) comment peut on caractériser la présence de l'ion sodium en solution aqueuse ?
réponse : on peut tester la solution contenant l'élément sodium par le test à la flamme , si la couleur est jaune on peut conclure qu'il y a présence de sodium
2) comment peut on caractériser la présence en milieu aqueux d'un acide comme l'acide acétique ?
b . action de l'acide éthanoique sur l'hydrogénocarbonate de sodium
dans un tube à essais, introduisez une pointe de spatule d'hydrogénocarbonate de sodium et quelques millitres d'acide acétique
1- noter vos observations
2-comment peut on caractériser le gaz formé ? schématisez le mode opératoire
réponse : on peut caractériser le gaz formé en le recueillant avec un tube à dégagement et en faisant le test à l'eau de chaux pour en déduire la présence ou non de CO 2
3- sachant que les autres produits formés sont l'ion sodium et l'ion éthanoate
que l'on notera par la suite A- (aq) et l'eau H20(l)
écrivez l'équation de la réaction
donc l'équation n'est pas équilibré
il y a 5 éléments hydrogène du coté gauche de l'équation et 3 éléments hydrogène du coté des produits de la réaction
j'ai l'impression que je me suis trompé dans l'équation
pouvez vous m'aidez ? s'il vous plait
Bonsoir trayas :
1). Ok pour le test de la flamme .
Comme les sels de sodium sont solubles dans l'eau , en voici un qui est insoluble.
Regarde sur Google ( réactif de String et réactif de Kolthoff ) .
L'acétate d'uranyle et de zinc est un composé chimique de formule UO2Zn2+(CH3COO-)2, qu'on trouve également écrite (UO2)2+Zn2+(CH3COO-)4 en considérant les cations uranyle UO22+ et zinc Zn2+ et l'anion acétate CH3COO-.
Il est utilisé comme réactif de laboratoire pour la détermination de la concentration de sodium en solution aqueuse à l'aide d'une méthode par précipitation quantitative du sodium avec de l'acétate d'uranyle et de zinc puis analyse gravimétrique pour doser le sodium sous forme d'acétate d'uranyle, de zinc et de sodium (UO2)2ZnNa(CH3COO)·9H2O.
La présence éventuelle d'impuretés de césium et de rubidium n'altère pas la mesure, en revanche le potassium et le lithium doivent être éliminés du milieu .
2). Ok pour le test avec de l'hydrogénocarbonate de sodium et dégagement de CO2
Encore odeur vinaigrée et pH .
3). NaHCO3 (aq) + CH3COOH (aq) =====> CH3COO-/Na+(aq) + H2O + CO2
Bonnes salutations .
Bonjour ;
je vous propose de continuer le TP avec la deuxième partie
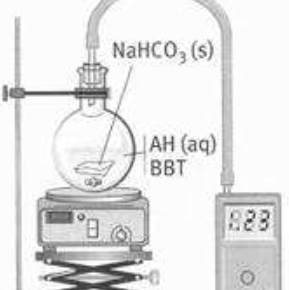
ETUDE QUANTITATIVE de la réaction à l'aide d'une mesure de pression
chaque groupe dispose d'un ballon et d'un bouchon percé dans lequel on introduit une tige en verre relié à un capteur de pression
mode opératoire
a- chaque groupe introduit dans le ballon un barreau aimanté ,puis, à l'aide d'une burette graduée un volume différent V Ad'une solution aqueuse d'acide de concentration molaire C = 0,50 mol.L-1
b- ce volume est complété à 20 ml par de l'eau distillée de manière à ce que le volume d'air présent au départ soit identique dans chaque ballon
c- ajouter quelques gouttes de bleu de bromothymol
d- bouchez le ballon et mesurez la pression initiale P i à l'intérieur
e- introduisez dans le ballon un morceau de papier filtre contenant 0,21 g d'hydrogénocarbonate de sodium
e -mettez en marche l'agitation magnétique et maintenez-la pendant la durée de la réaction
f -Relevez la pression à la fin de la transformation
résumez quelques grandeurs utiles (pour la suite)
V 1 -------------> le volume exact que peut contenir le ballon muni du bouchon
pour chaque groupe
V A---------------> le volume d'acide introduit
VE ----------------> le volume d'eau distillée rajouté dans le ballon
Remplissez le tableau récapitulatif
| Groupe | A | B | C | D | E | F | G | H |
| V AH (ml) | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 | 6,0 | 7,0 | 8,0 |
| V total (ml) | ||||||||
| P f | ||||||||
| ∆P=Pf -Pi |
le problème est que je ne suis pas en salle de TP puisque ce sont les vacances
si vous connaissez cet exercice , pouvez vous m'aider à remplir les premières lignes ??
Bonsoir,
pour remplir la première ligne , chaque groupe introduit un volume différent de solution d'acide donc j'ai pris une valeur qui va de 1m à 8ml
pour remplir la deuxième ligne
il faut compléter le volume d'acide introduit pour avoir un volume total de 20 ml
donc en fait c'est assez simple
je dois avoir ce tableau
| Groupe | A | B | C | D | E | F | G | H |
| V A (ml) | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 | 6,0 | 7,0 | 8,0 |
| V total (ml) | 19,0 | 18,0 | 17,0 | 16,0 | 15,0 | 14,0 | 13,0 | 12,0 |
| P i | ||||||||
| ∆P=Pf -Pi |
par contre pour les 2 dernières lignes , je ne sais pas comment faire ?
pouvez vous m'aider ???


