Inscription / Connexion Nouveau Sujet
TP Cinétique chimique - Influence du Solvant
Bonjour, je voudrais de l'aide pour quelques questions d'un TP de chimie pour lesquelles je bloque.
Sujet :
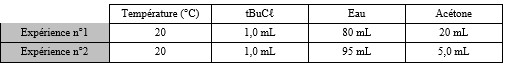
> On réalise deux expériences en mélangeant le tBuCℓ, l'eau et l'acétone selon les quantités indiquées dans le tableau. (Tableau)
> On réalise deux expériences en mélangeant le tBuCℓ, l'eau et l'acétone selon les quantités indiquées dans le tableau.
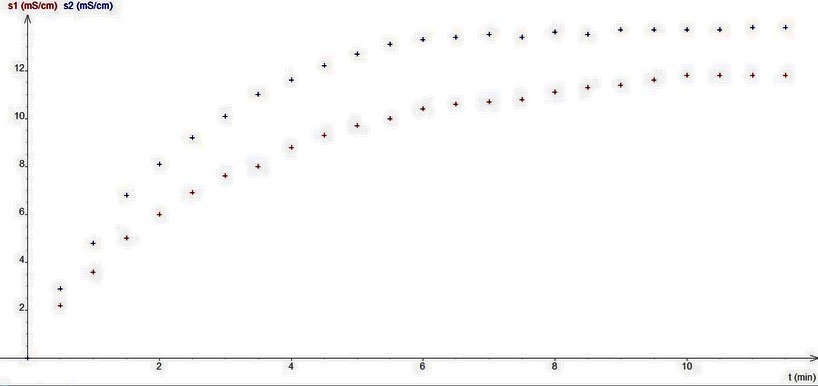
> Les valeurs de la conductivité de la solution au cours du temps sont notées ci-dessous. (Graphique)
Questions
1) Pourquoi cette transformation peut-elle être suivie par conductimétrie
> On peut effectuer un suivi conductimétrique lors de cette solution car elle est lente, et des ions sont formés au cours de la transformation.
2) Interprétez les variations de la conductivité de la solution.
?????
3) Commentez l'allure des courbes
La conductivité augmente rapidement jusqu'à t=6min puis elle se stabilise. De plus, on remarque que S2 est est supérieur a S1.
4) Déterminez le temps de demi-réaction pour chaque expériences.
S1 est : xf/2= 11,8/2 =5.9 t1/2= 2
S2 est xf/2=13.8/2=6.9 t1/2=1.5
5) Pourquoi peut-on dire que le solvant est un facteur cinétique ?
?????
Merci d'avance pour votre aide !
Bonsoir
L'équation de la réaction est :
La conductivité de la solution a pour expression :
où les deux " " désignent les conductivités molaires des deux ions produits et où C désigne la concentration commune aux ions chlorure et oxonium, concentration égale aussi à celle en alcool formé. Autrement dit, la conductivité de la solution est proportionnelle à la concentration en chacun des trois produits formés. Elle augmente donc au fur et à mesure que la réaction avance pour atteindre une constante lorsque la totalité du chlorure de tertiobutyle a réagit.
" désignent les conductivités molaires des deux ions produits et où C désigne la concentration commune aux ions chlorure et oxonium, concentration égale aussi à celle en alcool formé. Autrement dit, la conductivité de la solution est proportionnelle à la concentration en chacun des trois produits formés. Elle augmente donc au fur et à mesure que la réaction avance pour atteindre une constante lorsque la totalité du chlorure de tertiobutyle a réagit.
Attention ! le fait que la conductivité limite (ordonnée de l'asymptote horizontale) dans le cas 2 soit plus élevée ne signifie pas qu'une quantité plus grande de chlorure de tertiobutyle a réagit mais simplement que le fait que les conductivités molaires des deux ions sont d'autant plus élevées que la proportion d'acétone dans l'eau est faible. Dans les deux cas, la conductivité de la solution est proportionnelle à la concentration C mais la constante de proportionnalité n'est pas la même dans les deux cas !
OK pour 4 sauf pour les unités oubliées !
5 : t1/2 plus faible dans le second cas, alors que le seul paramètre ayant varié est la proportion eau-acétone. Le solvant est bien un facteur cinétique : plus la proportion d'eau dans le solvant est grande, plus la réaction est rapide. Il est cependant nécessaire d'utiliser un peu d'acétone car le chlorure de tertiobutyle ne se dissout pas totalement dans l'eau pure.


